题目内容
2.反应2A(g)?2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )| A. | 升温 | B. | 增大反应器的体积 | ||
| C. | 增大c(A) | D. | 降温 |
分析 正反应为放热反应,正反应速率降低,c(B)减小,则改变条件使平衡逆向移动、且速率减小,以此来解答.
解答 解:A.升高温度,反应速率加快,故A不选;
B.增大反应器的体积,压强减小,平衡逆向移动,则正反应速率降低,c(B)减小,故B选;
C.增大c(A),正反应速率增大,故C不选;
D.正反应为放热反应,降低温度,平衡正向移动,c(B)增大,故D不选;
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 海水中含有丰富的碘元素,因此碘被称为“海洋元素” | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
2.纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1: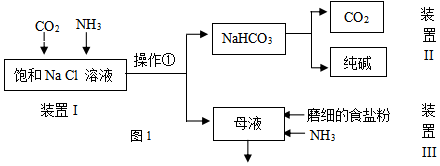
已知:几种盐的溶解度
(2)①写出装置I中反应的化学方程式NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl.
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:

已知:几种盐的溶解度
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
19.2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”.下列做法应提倡的是( )
| A. | 夏天设定空调温度尽可能的低 | B. | 推广使用一次性塑料袋和纸巾 | ||
| C. | 少开私家车多乘公共交通工具 | D. | 对商品进行豪华包装促进销售 |
6.H2O2分解速率受多种因素影响.实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示.下列说法正确的是( )
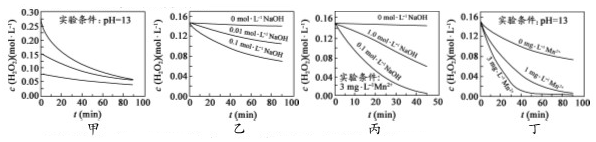

| A. | 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 | |
| B. | 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 | |
| C. | 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 | |
| D. | 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |
7.以下关于元素性质的比较正确的是( )
| A. | 稳定性:NH3>H2O>HF | B. | 离子半径:Na+<Mg2+<Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 金属还原性:Mg>Ca |
14.化学是建立在实验基础上的学科.关于下列各实验装置的叙述中,不正确的是( )

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
17.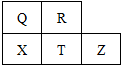 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )| A. | 五种元素中Z的活动性最弱,T 的最高价氧化物对应水化合物酸性最强 | |
| B. | 氢化物的稳定性:R>Q>X;R>T>X | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出Q单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |

 .
.  .
. $→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$
$→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$ (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).