题目内容
7.以下关于元素性质的比较正确的是( )| A. | 稳定性:NH3>H2O>HF | B. | 离子半径:Na+<Mg2+<Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 金属还原性:Mg>Ca |
分析 A.非金属性越强,对应氢化物的稳定性越强;
B.电子层相同时,离子的核电荷数越大,离子半径越小;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.同一主族元素中,原子序数越大,金属性越强.
解答 解:A.非金属性稳定性:F>O>N,非金属性越强,对应氢化物越稳定,则稳定性:NH3<H2O<HF,故A错误;
B.三种离子都含有2个电子层,离子的核电荷数越大,离子半径越小,则离子半径:Na+>Mg2+>Al3+,故B错误;
C.非金属性酸性:Cl>S>C,则最高价氧化物对应水合物的酸性:HClO4>H2SO4>H2CO3,故C正确;
D.Mg和Ca位于同一主族,原子序数越大,金属性越强,原子序数:Mg<Ca,则金属还原性:Mg<Ca,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容即可解答,B为易错点,注意掌握比较离子半径大小的方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.在给定条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Fe$→_{点燃}^{Cl_{2}}$FeCl2$\stackrel{NaOH(ap)}{→}$Fe(OH)2 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | CaCO3$\stackrel{高温}{→}$CaO$→_{高温}^{SiO_{2}}$CaSiO3 | |
| D. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
2.反应2A(g)?2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
| A. | 升温 | B. | 增大反应器的体积 | ||
| C. | 增大c(A) | D. | 降温 |
12.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
19.化学与生产、生活密切相关,下列与化学有关的说法正确的是( )
| A. | 铵态氮肥和草木灰混合使用可增加肥效 | |
| B. | 氢氟酸刻蚀水晶饰品体现其酸性 | |
| C. | 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法 | |
| D. | 煤经过气化和液化等物理变化可转为清洁能源 |
2.某充电宝属于锂钒氧化物凝胶电池,电池总反应为V2O4+xLi$?_{充电}^{放电}$LixV2O4,下列说法正确的是( )
| A. | 放电时正极上的电极反应为:V2O4+xe-+xLi+=LixV2O4 | |
| B. | 该充电宝的凝胶介质也可用KOH溶液代替 | |
| C. | 充电时电池的正极得到电子后LixV2O4转化为V2O4 | |
| D. | 放电时每消耗7gLi,就会有1mol电子通过凝胶 |
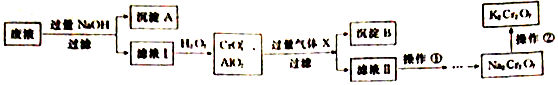
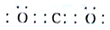 (填电子式)
(填电子式)
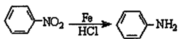 ,-NH2易被强氧化剂氧化
,-NH2易被强氧化剂氧化
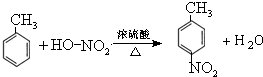 .
.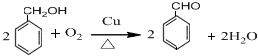 .
.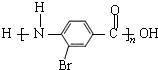 .
.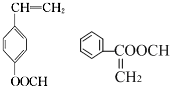 .
.