题目内容
15.常温下,向稀醋酸中不断加水稀释,始终保持不变的是( )| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | ||
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
分析 根据醋酸属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.
解答 解:A、加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,氢离子的物质的量增加,醋酸的量减少,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故A错误;
B、加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,醋酸根离子的物质的量增加,醋酸的量减少,所以$\frac{c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故B错误;
C、加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,氢离子的物质的量增加,而氢氧根离子的物质的量减少,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$减小,故C错误;
D、平衡常数K是温度的函数,温度不变K不变,所以向稀醋酸中不断加水稀释,$\frac{c({H}^{+})•c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值始终保持不变,故D正确;
故选D.
点评 本题考查弱电解质的稀释,明确稀释中电离程度、离子浓度、Ka的变化即可解答,比较容易.

练习册系列答案
相关题目
6.在一定条件下,向2L恒容密闭容器中加入2mol X、2mol Y.发生如下反应:
X(g)+Y(g)?Z(g);△H=-a kJ•mol-1(a>0).
经50s达平衡,此时Y的物质的量为1.2mol.下列说法错误的是( )
X(g)+Y(g)?Z(g);△H=-a kJ•mol-1(a>0).
经50s达平衡,此时Y的物质的量为1.2mol.下列说法错误的是( )
| A. | 用Z表示的化学反应速率为0.016 mol•L-1•s-1 | |
| B. | 恒温恒容下,通入Ne气,增大压强,Y的浓度不减小 | |
| C. | 恒温恒容下,再充入一定量的Z,重新达到平衡时,X的物质的量分数减小 | |
| D. | 达平衡后,实际放出的热量为b kJ,则b=a |
10.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | 用活性炭为糖脱色和用臭氧白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
7. 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )
 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )| A. | 实验装置中小烧杯杯中低于大烧杯杯口 | |
| B. | 用浓硫酸代替了稀硫酸 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度 |
5. 有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
 有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该有机物与足量溴水反应最多消耗3molBr2 | |
| C. | 1 mol该有机物最多能与2 mol NaOH反应 | |
| D. | 该有机物若能使酸性KMnO4溶液褪色,则可证明其分子中存在碳碳双键 |
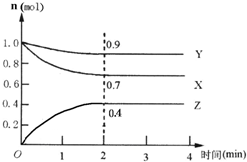 某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
 氮及其化合物在生产、生活中有着重要作用.
氮及其化合物在生产、生活中有着重要作用.