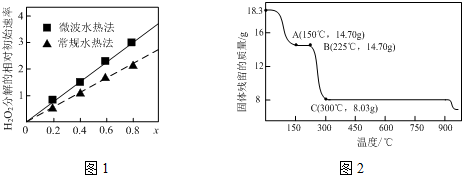
题目内容
20. 氮及其化合物在生产、生活中有着重要作用.
氮及其化合物在生产、生活中有着重要作用.(1)一氧化氮保健品是通过补充L一精氮酸从而在人体合成一氧化氮,现在市场说的一氧化氮保健品都是指以L一精氮酸为主要成分的产品.L一精氮酸的分子式为C6HxN4O2,相对分子质量为174,则x的数值为14.
(2)氯化铵简称“氯铵”,又称卤砂,是一种速效氮素化学肥料,NH4Cl溶液中各离子的物质的量浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(3)常温下,pH=12的氨水中存在电离平衡:NH3•H2O?NH4++OH-,向该氨水中加入少量0.01mol•L-1的NaOH溶液,保持不变的是A(填字母).
A.(OH-) B.c(NH4+)
C.(c(NH3•H2O) D.c(NH4+)•c(OH-).
分析 (1)根据相对分子质量为174及其分子式列式计算;
(2)铵根离子部分水解,溶液呈酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-);
(3)电离平衡:NH3•H2O?NH4++OH-中,加入少量0.01mol•L-1 NaOH溶液,其pH=12,则c(OH-)不变,由于溶液的总体积变大,则c(NH4+)、c(NH3•H2O)、c(NH4+)•c(OH-)均减少,以此来解答.
解答 解:(1)L一精氮酸的分子式为C6HxN4O2,相对分子质量为174,则:12×6+1×x+14×4+16×2=174,解得:x=14,
故答案为:14;
(2)在氯化铵的水溶液中,铵根离子水解显酸性,溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)A.电离平衡:NH3•H2O?NH4++OH-中,加入少量0.01mol•L-1 NaOH溶液,pH=12,与原溶液中c(OH-)相同,加入少量0.01mol•L-1 NaOH溶液,c(OH-)不变,故A正确;
B.加入少量0.01mol•L-1 NaOH溶液,其pH=12,则c(OH-)不变,由于溶液的总体积变大,c(NH4+)减小,故B错误;
C.加入少量0.01mol•L-1 NaOH溶液,其pH=12,则c(OH-)不变,由于溶液的总体积变大,c(NH3•H2O)减小,故C错误;
D.加入少量0.01mol•L-1 NaOH溶液,其pH=12,则c(OH-)不变,由于溶液的总体积变大,c(NH4+)减小,则c(NH4+)•c(OH-)减小,故D错误;
故答案为:A.
点评 本题考查较为综合,涉及离子浓度大小比较、盐的水解原理、弱电解质的电离及其影响等知识,题目难度中等,明确影响电离平衡的因素为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |

| A. | a极附近溶液呈红色 | |
| B. | a极电极反应方程式是:2H++2e-=H2↑ | |
| C. | b极附近溶液呈蓝色 | |
| D. | 溶液的pH变小 |
| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | ||
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
| A. | 食盐熔化 | B. | 晶体硅熔化 | C. | 碘升华 | D. | 氢氧化钠熔化 |
| A. | 灼热的炭与CO2反应 | B. | H-Cl→H+Cl | ||
| C. | H2SO4+2NaOH=Na2SO4+2H2O | D. | C(s)+H2O(g)=CO(g)+H2(g) |
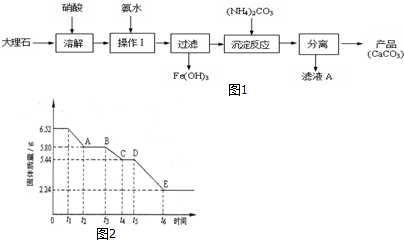
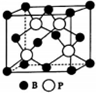 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.