题目内容
7. 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol-1(中和热),原因可能是( )| A. | 实验装置中小烧杯杯中低于大烧杯杯口 | |
| B. | 用浓硫酸代替了稀硫酸 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度 |
分析 A.小烧杯杯中低于大烧杯杯口,导致热量损失,则沉淀的中和热较低;
B.浓硫酸溶于水放出热量,导致测定的中和热偏高;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,导致热量散失;
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高.
解答 解:A.实验装置中小烧杯杯中低于大烧杯杯口,导致热量散失,则测定的中和热数据偏低,故A错误;
B.用浓硫酸代替了稀硫酸,浓硫酸溶于水放出热量,导致测定的中和热偏高,故B正确;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,导致热量散失较多,测定的中和热偏低,故C错误;
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故D错误;
故选B.
点评 本题考查了中和热的测定方法及误差分析,题目难度不大,明确中和热的测定方法为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
17.现有反应m A(g)+n B(g)?w C(g),测得在同一时间内A每分钟减少0.15mol/L,B每分钟减少0.05mol/L,C每分钟增加0.1mol/L,则下列叙述不正确的是( )
| A. | 在体积和温度不变的条件下,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| B. | m:n:w=3:1:2 | |
| C. | 单位时间内反应物浓度的减少等于生成物浓度的增加 | |
| D. | 在体积和温度不变的条件下,若在前10 s内A减少了xmol,则在同条件下,前20 s减少小于2x mol |
18.为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验.下列说法正确的是( )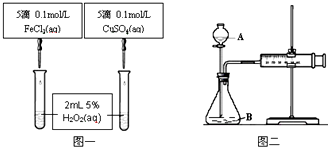

| A. | 图一可通过观察实验现象定量比较反应速率的大小 | |
| B. | 将CuSO4改为CuCl2更为合理 | |
| C. | 无法检查图二装置的气密性 | |
| D. | 图二所示实验中只需测量的数据是气体体积 |
15.常温下,向稀醋酸中不断加水稀释,始终保持不变的是( )
| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | ||
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
2.杀虫剂“阿乐丹”的结构简式为 ,该分子中官能团(不含苯环)不含有( )
,该分子中官能团(不含苯环)不含有( )
 ,该分子中官能团(不含苯环)不含有( )
,该分子中官能团(不含苯环)不含有( )| A. | 酯基 | B. | 碳碳双键 | C. | 醚键 | D. | 硝基 |
12.下列物质发生状态变化时,克服了分子间相互作用力的是( )
| A. | 食盐熔化 | B. | 晶体硅熔化 | C. | 碘升华 | D. | 氢氧化钠熔化 |
19.下列有关化学反应速率的说法中,正确的是( )
| A. | 2mol/L盐酸与锌反应时,加入4mol/L的氯化钠溶液,生成氢气的速率加快 | |
| B. | 对于可逆反应2CO+2NO?N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 | |
| C. | 工业上合成氨是放热反应,升高温度,正反应速率减慢 | |
| D. | 在K2SO4和BaCl2两溶液反应时,增大压强,生成沉淀速率加快 |
16.在一定条件下的定容密闭容器中,下列说法能表明反应A(s)+2B(g)═C(g)+D(g) 已达平衡状态的是( )
| A. | 混合气体的压强不再改变 | |
| B. | 单位时间内生成n mol A的同时,生成2n mol的B | |
| C. | C的生成速率是B 的生成速率的两倍 | |
| D. | 混合气体的密度不再改变 |