题目内容
11.下列溶液中的c(Cl-)与50mL1mol/LFeCl3溶液中的c(Cl-)相等的是( )| A. | 1mol/LNaCl溶液 | B. | 2mol/LNH4Cl溶液 | ||
| C. | 1.5mol/LMgCl2溶液 | D. | 2mol/LAlCl3溶液 |
分析 根据化学式可知1mol•L-1的FeCl3溶液中氯离子浓度为3mol/L,结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关.
解答 解:50mL 1mol•L-1FeCl3溶液中,氯离子的物质的量浓度为:1mol•L-1×3=3mol•L-1,
A、1 mol•L-1NaCl溶液中,Cl-浓度为1mol•L-1×1=1mol•L-1,故A错误;
B、2mol•L-1NH4Cl溶液中,Cl-浓度为2mol•L-1×1=2mol•L-1,故B错误;
C、1.5 mol/L MgCl2溶液中,Cl-浓度为1.5mol•L-1×2=3mol•L-1,故C正确;
D、2 mol•L-1AlCl3溶液,Cl-浓度为2mol•L-1×3=6mol•L-1,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,难度不大,明确物质的构成是解答本题的关键,并注意离子的浓度与溶液的浓度的关系来解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.决定元素种类的是( )
| A. | 质子数 | B. | 电子数 | C. | 中子数 | D. | 质子数和中子数 |
16.现有三个体积相等的密闭容器中都进行如下反应:CO2+H2?CO+H2O,反应所处温度相同,但反应起始的浓度不同,其中,甲:c(H2)=c(CO2)=amol/L
乙:c(CO2)=amol/L c(H2)=2amol/L
丙:c(CO2)=c(H2)=c(H2O)=amol/L
达到平衡时,一氧化碳的浓度由大到小排列正确的是( )
乙:c(CO2)=amol/L c(H2)=2amol/L
丙:c(CO2)=c(H2)=c(H2O)=amol/L
达到平衡时,一氧化碳的浓度由大到小排列正确的是( )
| A. | 丙>甲>乙 | B. | 甲>乙>丙 | C. | 乙>丙>甲 | D. | 乙>甲>丙 |
20.下列叙述中,正确的是( )
| A. | 中和10 mL 0.1 mol•L-1 醋酸与中和100 mL 0.01 mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |

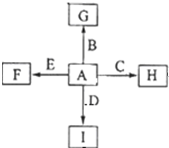 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: