题目内容
7.设NA为阿伏加德罗常数的值.下列说法中,正确的是( )| A. | 标准状况下,22.4L的NO2和CO2混合气体中含有的氧原子数为4NA | |
| B. | 密闭容器中,46gNO2和N2O4的混合气体所含分子个数为NA | |
| C. | 常温常压下,22.4L的液态水含有2.24×10-8NA个OH- | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
分析 A.标准状况下22.4L混合气体的物质的量为1mol,1molNO2和CO2混合气体中含有2molO原子;
B.没有告诉二氧化氮和四氧化二氮的组成,无法计算含有分子数;
C.常温常压下,水中氢离子浓度为1×10-7mol/L,根据n=cV计算出氢氧根离子的物质的量;
D.铁与水蒸气反应生成四氧化三铁,根据n=$\frac{m}{M}$计算出铁的物质的量,然后计算出转移电子的物质的量及数目.
解答 解:A.标准状况下,22.4L的NO2和CO2混合气体的物质的量为1mol,1mol该混合气体中含有2mol氧原子,含有的氧原子数为2NA,故A错误;
B.没有告诉46gNO2和N2O4的混合气体中二者组成情况,无法计算含有分子数,故B错误;
C.常温常压下,水中氢离子浓度为1×10-7mol/L,22.4L水中含有氢氧根离子的物质的量为:1×10-7mol/L×22.4L=2.24×10-6mol,含有2.24×10-6NA个OH-,故C错误;
D.四氧化三铁中铁元素的化合价为+$\frac{8}{3}$价,16.8g铁的物质的量为:$\frac{16.8g}{56g/mol}$=0.3mol,0.3mol与水蒸气完全反应生成四氧化三铁转移的电子的物质的量为:0.3mol×($\frac{8}{3}$-0)=0.8mol,则反应失去0.8NA个电子,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,D为易错点,注意铁与水反应生成四氧化三铁,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
15.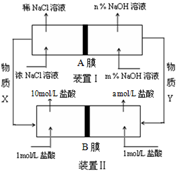 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
2.下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | 油脂和汽油都是油 | 一定条件下都能发生皂化反应 |
| B | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| C | 蔗糖、淀粉、纤维素是还原性糖 | 它们一定条件下都能发生银镜反应 |
| D | 蛋白质结构中存在肽键 | 蛋白质能表现出两性 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的某二元弱碱的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 25℃时,pH=12的氨水和pH=12的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | 等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合:c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO${\;}_{4}^{2-}$)+c(NH${\;}_{4}^{+}$)+c(H+)+c(OH-) |
20.下列离子方程错误的是( )
| A. | 碳酸氢钠溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 向氯化铁溶液中投入铜粉 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 少量的二氧化碳通入次氯酸钙溶液 Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| D. | 铜与稀硝酸反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
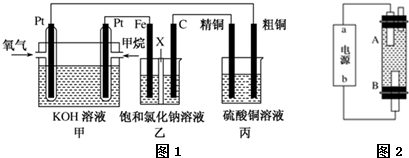
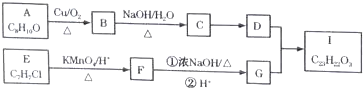
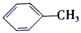 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$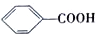
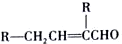
 .
. .
.
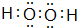 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.