题目内容
17.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: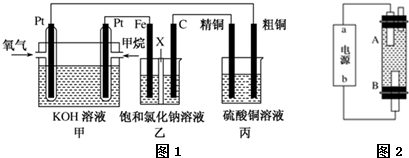
(1)甲烷燃料电池负极反应式是CH4+10OH--8e-=CO32-+7H2O;
(2)石墨(C)极的电极反应式为2Cl--2e-=Cl2↑;
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为4.48L,丙装置中阴极析出铜的质量为12.8g;
(4)某同学利用甲烷燃料电池设计电解法制取Fe(OH)2的实验装置(如图所示),用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用铁作电极.
分析 燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应;
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积、丙装置中析出铜的质量;
(4)若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
解答 解:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:
CH4+10OH--8e-=CO32-+7H2O.
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑.
故答案为:2Cl--2e-=Cl2↑.
(3)串联电池中转移电子数相等,若在;准状况下,有2.24L氧气参加反应,则转移电子的物质的量=$\frac{2.24L}{22.4L/mol}$,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg.
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48
2Cu 2++2e-=Cu
2mol 64g
0.4mol yg
y=12.8
故答案为:4.48;12.8;
(4)如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
故答案为:铁.
点评 本题考查了原电池和电解池原理及物质的量的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难点是(4)题中电解质溶液的选取及电极材料的选取,根据实验目的进行正确选取即可.

(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-(填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-(填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
(4)实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上层为黄色、下层为橙红色.
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与稀硝酸的反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | CaCO3与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| D. | 实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl-═Mn2++Cl2↑+H2O |
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |
| A. | 25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 | |
| B. | 25℃时,pH=11的NaOH溶液加水稀释100倍后pH=9 | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水等体积混合后,pH=7 | |
| D. | 90℃时,纯水的pH=6.2,所以加热可以使水呈酸性 |
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
| A. | 分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH | |
| B. | pH=a的CH3COOH溶液加水稀释10n倍后,pH=a+n | |
| C. | pH相等的CH3COONa、NaOH溶液中,水的电离程度相同 | |
| D. | Na2CO3溶液中:c(OH-)=c(H+)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) |
| A. | 标准状况下,22.4L的NO2和CO2混合气体中含有的氧原子数为4NA | |
| B. | 密闭容器中,46gNO2和N2O4的混合气体所含分子个数为NA | |
| C. | 常温常压下,22.4L的液态水含有2.24×10-8NA个OH- | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |