题目内容
7.下列除杂质的操作中不正确的是( )| A. | 除去SO2中的少量HCl:通入饱和NaHSO3溶液的洗气瓶,干燥后收集气体 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液 | |
| D. | 除去SiO2中的少量Al2O3:加入适量稀硫酸充分反应后过滤 |
分析 A.HCl与亚硫酸氢钠反应生成二氧化硫;
B.Fe与氯化铁反应生成氯化亚铁;
C.碳酸氢钠加热分解生成碳酸钠;
D.氧化铝与硫酸反应,而二氧化硅不能.
解答 解:A.HCl与亚硫酸氢钠反应生成二氧化硫,则通入饱和NaHSO3溶液的洗气瓶,干燥后收集气体可除杂,故A正确;
B.Fe与氯化铁反应生成氯化亚铁,则加入过量铁粉充分反应后过滤可除杂,故B正确;
C.碳酸氢钠加热分解生成碳酸钠,则加热可除杂,不能加NaOH溶液,故C错误;
D.氧化铝与硫酸反应,而二氧化硅不能,则加入适量稀硫酸充分反应后过滤可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高考常见题型,侧重于学生的分析能力的考查,注意把握物质性质差异及元素化合物知识综合应用为解答该类题目的关键,题目难度不大.

练习册系列答案
相关题目
2.下列性质的比较中,不正确的是( )
| A. | 稳定性:Na2CO3>NaHCO3 | B. | 熔点:生铁>纯铁 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
12.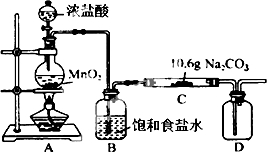 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)该实验装置明显存在不足之处,改进的措施为在装置D后连接以尾气处理装置
(3)已知在装置C中通入一定量的氯气后,观察到测得D中有黄红色的气体(提示:是一种氯的氧化物).已知C中所得固体含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3、NaCl
假设二:存在三种成分,为NaHCO3、Na2CO3、NaCl
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
若C中有0.1molCl2恰好与10.6gNa2CO3反应,且假设一成立,由此可推知C中反应生成的氯的氧化物为Cl2O(写化学式),写出C中发生反应的化学方程式2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O.
 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)该实验装置明显存在不足之处,改进的措施为在装置D后连接以尾气处理装置
(3)已知在装置C中通入一定量的氯气后,观察到测得D中有黄红色的气体(提示:是一种氯的氧化物).已知C中所得固体含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3、NaCl
假设二:存在三种成分,为NaHCO3、Na2CO3、NaCl
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 步骤 | 预期现象和结论 |
| 步骤1:取C中少量样品于试管中,滴加足量蒸馏水 至溶解,然后将所得溶液分别置于A、B试管中 | 固体物质全部完全溶解 |
| 步骤:向A试管中滴加适量BaCl溶液 | a. 如果 b. 如果 |
| 步骤: | 有白色沉淀生成,C的部分有NaCl |
若C中有0.1molCl2恰好与10.6gNa2CO3反应,且假设一成立,由此可推知C中反应生成的氯的氧化物为Cl2O(写化学式),写出C中发生反应的化学方程式2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O.
19.氯化硼的熔点为-107℃、沸点为12.5℃,在氯化硼分子中,氯-硼-氯键角为120°,它可以水解,水解产物之一是氯化氢,下列对氯化硼的叙述中正确的是( )
| A. | 氯化硼是原子晶体 | |
| B. | 熔化时,氯化硼能导电 | |
| C. | 硼原子以sp3杂化 | |
| D. | 水解方程式:BCl3+3H2O═H3BO3+3HCl |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 LH2O含有的分子数为NA | |
| B. | 1molAl3+离子含有的核外电子数为3NA | |
| C. | 3mol Fe在高温下与足量的水蒸汽反应转移的电子数为8NA | |
| D. | 1molNa2O2与足量的水反应失去电子数为2NA |
17.乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )
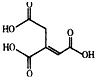

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能发生水解反应和加成反应 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含1mol乌头酸的溶液最多可消耗3molNaOH |
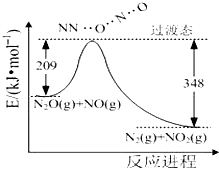 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: