题目内容
15. 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
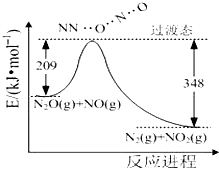
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:(1)由N2O和NO反应生成N2和NO2的能量变化如图所示,写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1.
(2)NH4NO3(s)加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{250℃}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);
(3)常温下,要除去NH4Cl溶液中的杂质Fe3+,加入氨水调至溶液的pH等于8,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤后滤液中残留c(Fe3+)=4.0×10-20mol/L.[已知KspFe(OH)3=4.0×10-38]
(4)污染环境的NO2气体可用氨水吸收生成NH4NO3氮肥,25℃时,若向含2mol NH4NO3的溶液中滴加1L氨水后使溶液呈中性,则所滴加氨水的浓度为1×10-2mol/L.(已知氨水的电离平衡常数取Kb=2×10-5mol/L)
分析 (1)由图可知△H=209kJ/mol-348kJ/mol=-139kJ/mol,结合物质的状态及反应物、生成物书写;
(2)由反应物、生成物可知化学反应,K为生成物浓度幂之积与反应物浓度幂之积的比;
(3)pH等于8,c(OH-)=10-6mol/L,结合Ksp计算;
(4)滴加1L氨水后使溶液呈中性,则c(OH-)=10-7mol/L,由电荷守恒可知c(NH4+)=c(NO3-),结合NH3•H2O的电离平衡常数Kb=2×10-5 mol•L-1计算.
解答 解:(1)该反应中△H=209kJ/mol-348kJ/mol=-139kJ/mol,所以其热化学反应方程式为:N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1,
故答案为:N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{250℃}{?}$N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),故答案为:NH4NO3$\stackrel{250℃}{?}$N2O+2H2O;K=c(N2O)×c2(H2O);
(3)pH等于8,c(OH-)=10-6mol/L,溶液中的Fe3+转化为Fe(OH)3沉淀,过滤后滤液中残留c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-6})^{3}}$mol/L=4.0×10-20mol/L,
故答案为:4.0×10-20;
(5)滴加1L氨水后使溶液呈中性,则c(OH-)=10-7mol/L,由电荷守恒可知c(NH4+)=c(NO3-)=2mol/L,由NH3•H2O?NH4++OH-及NH3•H2O的电离平衡常数Kb=2×10-5 mol•L-1,则c(NH3•H2O)=$\frac{2mol/L×1{0}^{-7}mol/L}{2×1{0}^{-5}mol/L}$=1×10-2mol/L,故答案为:1×10-2.
点评 本题考查较综合,涉及热化学反应、化学平衡的意义及计算,为高频考点,侧重于学生的分析、应用能力的考查,题目难度不大,注意把握平衡常数及计算方法为解答的关键,学习中注意相关基础知识的积累.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案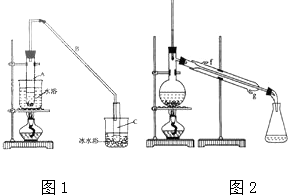 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1),已知:
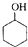 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$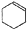 +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入(填字母).蒸馏时要加入生石灰,目的是吸收生成的水,防止水蒸气随环己烯一起蒸出;
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc(填字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
| 加入的物质 | 结论 | |
| A | 100mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cu | B. | NaOH溶液 | C. | 熔融Na2CO3 | D. | 乙醇 |
| A. | 除去SO2中的少量HCl:通入饱和NaHSO3溶液的洗气瓶,干燥后收集气体 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液 | |
| D. | 除去SiO2中的少量Al2O3:加入适量稀硫酸充分反应后过滤 |
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- | |
| C. | 某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ | |
| D. | 某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |


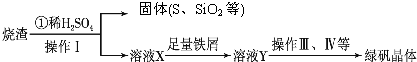
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.