题目内容
6.向KNO3溶液中滴加少量浓盐酸,然后分成等量的三份,第一份滴入淀粉碘化钾溶液,溶液将变成蓝色;第二份加人铜粉,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+H2O;第三份滴加少量AgNO3溶液,将看到有白色沉淀生成.分析 向KNO3溶液中滴加少量浓盐酸,酸性条件下NO3-有强氧化性,相当于溶液中含有HNO3,硝酸能氧化碘离子生成碘,能与Cu发生氧化还原反应,Cl-能和AgNO3发生复分解反应,据此分析解答.
解答 解:向KNO3溶液中滴加少量浓盐酸,酸性条件下NO3-有强氧化性,相当于溶液中含有HNO3,硝酸能氧化I-生成碘,碘遇淀粉试液变蓝色,所以第一份溶液变成蓝色;
HNO3能与Cu发生氧化还原反应,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
氯离子能和硝酸银发生复分解反应,离子方程式为Ag++Cl-=AgCl↓,产生白色沉淀,所以看到的现象是有白色沉淀生成,
故答案为:蓝;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;白色沉淀.
点评 本题考查硝酸的性质,为高频考点,硝酸具有强氧化性、具有酸性,明确混合溶液中溶质性质是解本题关键,注意:酸性条件下硝酸根离子的强氧化性,题目难度不大.

练习册系列答案
相关题目
16.已知 25℃时有关弱酸的电离平衡常数如下:
下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
1.DDT是被禁用的有机污染物,它的结构简式为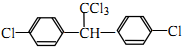 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )
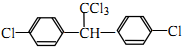 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共平面 | ||
| C. | 分子式为C14H9Cl5 | D. | 能发生水解反应和消去反应 |
6.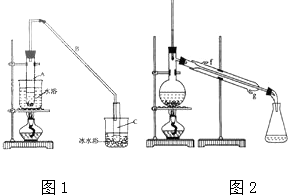 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1),
已知: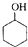 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$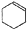 +H2O
+H2O
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入(填字母).蒸馏时要加入生石灰,目的是吸收生成的水,防止水蒸气随环己烯一起蒸出;
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc(填字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1),已知:
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入(填字母).蒸馏时要加入生石灰,目的是吸收生成的水,防止水蒸气随环己烯一起蒸出;
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc(填字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
7.下列除杂质的操作中不正确的是( )
| A. | 除去SO2中的少量HCl:通入饱和NaHSO3溶液的洗气瓶,干燥后收集气体 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液 | |
| D. | 除去SiO2中的少量Al2O3:加入适量稀硫酸充分反应后过滤 |
 .
.