题目内容
5.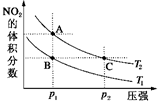 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
分析 N2O4(g)═2NO2(g)△H=+57kJ•mol-1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
A、AC两点都在等温线上,压强越大,反应速率越快;
B、增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
C、增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,据此判断;
D、压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,A点NO2的体积分数大;
解答 解:A.由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故A错误;
B.由图象可知,A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A、C两点气体的颜色:A浅,C深,故B错误;
C.由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:A<C,故C错误;
D.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故D正确;
故选:D.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”原则即可解答,难度不大.注意B选项为易错点,改变压强的本质为体积变化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15. 有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )
有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )
 有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )
有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )| A. | 到达平衡后,若使用催化剂,C的质量分数增大 | |
| B. | 平衡后,若升高温度,平衡则向逆反应方向移动 | |
| C. | 平衡后增大A的量,有利于提高A的转化率 | |
| D. | 化学方程式中一定是m+n<p+q |
16.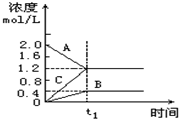 在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )
在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )
 在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )
在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )| A. | t1时刻之后,若再加入一定量的A,达平衡时A的转化率降低 | |
| B. | t1时刻之后,3v(A)逆=2v(C)正 (v-速率) | |
| C. | t1时刻之后,若升高温度,混合气体的平均摩尔质量增大,则该反应A消耗的方向为吸热反应 | |
| D. | 在温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时A的体积分数为3/7 |
13.将30mL5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
| A. | 0.3 mol/L | B. | 3 mol/L | C. | 0.15 mol/L | D. | 1.5 mol/L |
14.碘元素有“智力元素”之称.研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量.

(1)操作Ⅰ为灼烧,则灼烧时用坩埚 盛装海带,操作Ⅱ为过滤
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2S2O32-═2I-+S4O62-
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCL2溶液、稀硫酸
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4
溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B
②在溶液B加入两滴淀粉溶液,用0.01mol/LNaS2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量$\frac{1.27V}{a}$×100%.
(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)

(1)操作Ⅰ为灼烧,则灼烧时用坩埚 盛装海带,操作Ⅱ为过滤
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2S2O32-═2I-+S4O62-
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCL2溶液、稀硫酸
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 |  |
| ② | 往试管Ⅰ中加入FeCl2溶液后,加入2滴KSCN溶液并振荡 | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4
溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B
②在溶液B加入两滴淀粉溶液,用0.01mol/LNaS2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量$\frac{1.27V}{a}$×100%.
(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)