题目内容
15.有反应①Cl2+SO2+2H2O═H2SO4+2HCl②2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,针对两个反应回答:
(1)氧化剂的氧化性强弱顺序为KMnO4>Cl2>H2SO4,还原剂的还原性强弱顺序为SO2>HCl>MnCl2;
(2)反应①中氧化产物与还原产物质量比为98:73;
(3)反应②中HCl表现出的性质是ab(填字母).
a.还原性 B.酸性 c.氧化性.
分析 ①Cl2+SO2+2H2O═H2SO4+2HCl中Cl元素的化合价升高,S元素的化合价降低;
②2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,
(1)氧化剂的氧化性大于氧化产物的氧化性,而还原剂的还原性大于还原产物的还原性;
(2)反应①中氧化产物为H2SO4,还原产物为HCl;
(3)反应②中生成盐体现盐酸的酸性,且生成氯气,体现盐酸的还原性.
解答 解:①Cl2+SO2+2H2O═H2SO4+2HCl中Cl元素的化合价升高,S元素的化合价降低;
②2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,
(1)由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为KMnO4>Cl2>H2SO4,由还原剂的还原性大于还原产物的还原性可知,还原性为SO2>HCl>MnCl2,
故答案为:KMnO4>Cl2>H2SO4;SO2>HCl>MnCl2;
(2)反应①中氧化产物为H2SO4,还原产物为HCl,二者的质量比为98:36.5×2=98:73,故答案为:98:73;
(3)反应②中生成盐体现盐酸的酸性,且生成氯气,体现盐酸的还原性,即HCl表现出的性质是ab,故答案为:ab.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应中的规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.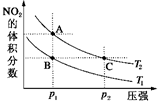 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
6.下列离子方程式书写不正确的是( )
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量CO2通入NaOH溶液中,:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和KHSO4溶液反应:OH-+H+═H2O | |
| D. | Na2O溶于稀盐酸:O2-+2H+═H2O |
7.下列反应(或反应组)以说明碳的非金属性强于硅的是( )
| A. | SiO32-+2CO2+2H2O→H2SiO3+2HCO3- | |
| B. | SiO2+2C$\stackrel{高温}{→}$Si+2CO↑ | |
| C. | SiH4$\stackrel{500℃}{→}$Si+2H2;CH4$\stackrel{>1000℃}{→}$C+2H2 | |
| D. | Si+O2$\stackrel{900℃}{→}$SiO2;C+O2$\stackrel{300℃}{→}$CO2 |
 某种物质的结构如图所示,它是某种烃的衍生物的3个分子间相互加成生成的,这种烃的衍生物是甲醛.
某种物质的结构如图所示,它是某种烃的衍生物的3个分子间相互加成生成的,这种烃的衍生物是甲醛.