题目内容
20.把18.0mol/L的浓硫酸稀释成2.00mol/L的稀硫酸100mL.(1)实验操作如下,正确的操作步骤是③④⑥⑤⑧⑦②①(填序号).
①将配好的稀硫酸倒入试剂瓶中,贴好标签
②盖好容量瓶塞,反复颠倒,摇匀
③用量筒量取11.1mL的18.0mol/L的浓硫酸
④将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中
⑥将已冷却至室温的硫酸溶液沿玻璃棒注入100mL的容量瓶中
⑦改用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度线相切
⑧继续向容量瓶中加蒸馏水,直到液面接近刻度线1至2cm处
(2)下列操作对所配溶液浓度造成的后果,请选填“偏高”、“偏低”或“无影响”:
①未洗涤稀释过浓硫酸的小烧杯偏低;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸无影响;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出偏低;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥无影响;
⑤定容时俯视刻度偏高;
⑥倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度偏低.
分析 (1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(2)$\frac{n}{V}$根据c=并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序为:③④⑥⑤⑧⑦②①,故答案为:③④⑥⑤⑧⑦②①;
(2)①未洗涤稀释过浓硫酸的小烧杯,会导致溶质的损失,则浓度偏低,故答案为:偏低;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸,对所配溶液的浓度无影响,故答案为:无影响;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出,则吸出的不止是水,还有溶质,故浓度偏低,故答案为:偏低;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥,对所配溶液的浓度无影响,故答案为:无影响;
⑤定容时俯视刻度,则溶液体积偏小,浓度偏高,故答案为:偏高;
⑥倒转容量瓶摇匀后,液面降至刻度线下是正常的,再加水至刻度,则浓度偏低,故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.在1.5mol Na2SO4中,含有的Na+数是( )
| A. | 1.806×1024 | B. | 9.03×1023 | C. | 1.5 | D. | 3 |
5.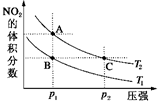 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
9.为了除去CO2中的O2、SO2、H2O(g)等杂质,可用①NaHCO3饱和溶液②浓硫酸③加热的铜网,通过以上试剂顺序净化效果最好的是( )
| A. | ②③① | B. | ③② | C. | ②①③ | D. | ①②③ |
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题: