题目内容
16.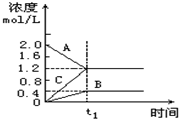 在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )
在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )| A. | t1时刻之后,若再加入一定量的A,达平衡时A的转化率降低 | |
| B. | t1时刻之后,3v(A)逆=2v(C)正 (v-速率) | |
| C. | t1时刻之后,若升高温度,混合气体的平均摩尔质量增大,则该反应A消耗的方向为吸热反应 | |
| D. | 在温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时A的体积分数为3/7 |
分析 图象分析可知,A浓度减小为反应物,BC浓度增大为生成物,反应过程中A消耗浓度=2.0mol/L-1.2mol/L=0.8mol/L,B生成浓度为0.4mol/L,C生成浓度为1.2mol/L,反应物质的量之比等于化学方程式计量数之比=0.8:0.4:1,2=2:1:3,该反应的方程式为:2A?B+3C,
A、t 1 时刻之后,若再加入一定量的A,相当于增大了压强,平衡向逆反应方向移动;
B、t 1 时刻之后,反应已达平衡状态,即正、逆反应速率之比等于化学方程式计量数之比,为正反应速率之比;
C、t 1 时刻之后,若升高温度,混合气体的平均摩尔质量增大,由于反应物和生成物均为气体,即体系总质量不变,所以混合气体的总物质的量减小,M=$\frac{m}{n}$分析;
D、温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时与起始时投入2molA,达到相同的平衡状态,互为等效平衡;
解答 解:图象分析可知,A浓度减小为反应物,BC浓度增大为生成物,反应过程中A消耗浓度=2.0mol/L-1.2mol/L=0.8mol/L,B生成浓度为0.4mol/L,C生成浓度为1.2mol/L,反应物质的量之比等于化学方程式计量数之比=0.8:0.4:1,2=2:1:3,该反应的方程式为:2A?B+3C,
A、t 1 时刻之后,若再加入一定量的A,相当于增大了压强,平衡向逆反应方向移动,即达平衡时A的转化率降低,故A正确;
B、t 1 时刻之后,反应已达平衡状态,即正、逆反应速率之比等于化学方程式计量数之比,3v(A) 逆=2v(C) 正,说明A的正逆反应速率相同,反应达到平衡状态,故B正确;
C、t 1 时刻之后,若升高温度,混合气体的平均摩尔质量增大,由于反应物和生成物均为气体,即体系总质量不变,所以混合气体的总物质的量减小,即可得平衡向逆反应方向移动,得正反应的方向为放热反应,故C错误;
D、温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时与起始时投入2molA,达到相同的平衡状态,互为等效平衡,平衡状态下AC浓度为1.2mol/L,C浓度为0.04mol/L,A的体积分数=$\frac{1.2}{1.2+1.2+0.4}$=$\frac{3}{7}$,故D正确;
故选A.
点评 本题考查了图象分析,化学平衡响因素的理解应用,主要是化学方程式计算书写,平衡移动原理的分析判断,掌握基础是解题关键,题目难度中等.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | 需要加热才能发生的反应不一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 反应物和生成物具有的总能量决定了反应是吸热还是放热 | |
| D. | 吸热反应在一定条件下(如加热等)也能够发生 |
| A. | 常温常压下22.4LCO2分子数少于NA | B. | 1molNaHCO3固体中含有NA个CO32- | ||
| C. | NA个NO与NA个O2混合分子数为2NA | D. | 1molCu反应转移电子数一定是2NA |
| A. | 1.806×1024 | B. | 9.03×1023 | C. | 1.5 | D. | 3 |
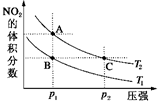 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量CO2通入NaOH溶液中,:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和KHSO4溶液反应:OH-+H+═H2O | |
| D. | Na2O溶于稀盐酸:O2-+2H+═H2O |
 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.