题目内容
17.根据要求书写反应方程式.①以饱和FeCl3溶液为原料制备Fe(OH)3胶体的离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+.
②研究表明,Na2FeO4是一种高效多功能水处理剂,应用前景广阔,可用FeSO4和Na2O2反应制备,在反应中,FeSO4与Na2O2的物质的量之比为1:3,其中Na2O2既是氧化剂,又是还原剂,已知产物中,除Na2FeO4外,还有Na2O、Na2SO4等,试写出该反应的化学方程式.2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.
分析 ①铁离子在溶液中水解生成氢氧化铁胶体和氢离子,据此写出反应的离子方程式;
②FeSO4和Na2O2反应,FeSO4与Na2O2的物质的量之比为1:3,已知产物中,除Na2FeO4外,还有Na2O、Na2SO4等,反应中其中Na2O2既是氧化剂,又是还原剂,说明过氧化钠中O元素的化合价即升高又降低,升高时生成氧气,即产物中还有氧气生成,结合原子守恒和电子守恒书写配平方程式.
解答 解:①饱和FeCl3溶液为原料制备Fe(OH)3胶体的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+,
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+;
②FeSO4和Na2O2反应,FeSO4与Na2O2的物质的量之比为1:3,已知产物中,除Na2FeO4外,还有Na2O、Na2SO4等,反应中其中Na2O2既是氧化剂,又是还原剂,说明过氧化钠中O元素的化合价即升高又降低,升高时生成氧气,即产物中还有氧气生成,所以该反应的反应物为FeSO4和Na2O2,生成物为Na2FeO4、Na2O、2Na2SO4和O2,其反应方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,
故答案为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.
点评 本题考查了离子方程式、化学方程式的书写,题目难度中等,明确离子方程式、化学方程式的书写原则为解答关键,②为难点、易错点,注意掌握氧化还原反应的配平方法.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
8.在1.5mol Na2SO4中,含有的Na+数是( )
| A. | 1.806×1024 | B. | 9.03×1023 | C. | 1.5 | D. | 3 |
5.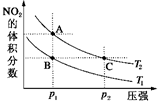 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
9.为了除去CO2中的O2、SO2、H2O(g)等杂质,可用①NaHCO3饱和溶液②浓硫酸③加热的铜网,通过以上试剂顺序净化效果最好的是( )
| A. | ②③① | B. | ③② | C. | ②①③ | D. | ①②③ |
6.下列离子方程式书写不正确的是( )
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量CO2通入NaOH溶液中,:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和KHSO4溶液反应:OH-+H+═H2O | |
| D. | Na2O溶于稀盐酸:O2-+2H+═H2O |
7.下列反应(或反应组)以说明碳的非金属性强于硅的是( )
| A. | SiO32-+2CO2+2H2O→H2SiO3+2HCO3- | |
| B. | SiO2+2C$\stackrel{高温}{→}$Si+2CO↑ | |
| C. | SiH4$\stackrel{500℃}{→}$Si+2H2;CH4$\stackrel{>1000℃}{→}$C+2H2 | |
| D. | Si+O2$\stackrel{900℃}{→}$SiO2;C+O2$\stackrel{300℃}{→}$CO2 |
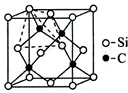 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:


