题目内容
15.根据如图能量变化曲线判断,下列说法正确的是( )
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |
分析 A.根据反应2H2(g)+O2(g)═2H2O(g)的能量变化图可知,△H=-484KJ/mol,当生成液态水时,放出热量多于484KJ热量,可根据盖斯定律求算;
B.根据图示得到生成气态水反应的焓变,化学反应的焓变△H=H产物-H反应物=反应物键能总和-生成物键能总和计算得到;
C.燃烧热必须是可燃物质完全燃烧生成稳定的氧化物放出的热量;
D.根据n=$\frac{m}{M}$计算出氢气的物质的量结合氢气的燃烧热解答.
解答 解:A.根据反应2H2(g)+O2(g)═2H2O(g)的能量变化图可知,①2H2(g)+O2(g)═2H2O(g)△H=-484KJ/mol,②2H2O(g)═2H2O(l)△H=-88KJ/mol,将(①+②)÷2得H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286KJ/mol,故A错误;
B.根据图是信息得到:O2(g)+2H2(g)=2H2O(g)△H=-484kJ•mol-1,设H-O键的键能为xkJ•mol-1,H-H、O=O的键能分别是436kJ•mol-1和496kJ•mol-1,△H=2×436+496-4x=-484,解得x=463kJ•mol-1,故B正确;
C.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286KJ/mol,氢气的燃烧热为286kJ•mol-1,故C错误;
D.10克氢气n=$\frac{m}{M}$=$\frac{10g}{2g/mol}$=5mol,H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286KJ/mol,完全燃烧,放出热量为(5×286)=1430kJ,故D错误;
故选B.
点评 本题考查了根据能量变化曲线判断热化学方程式的分析应用,为高频考点,侧重于学生的分析能力的考查,注意物质能量的变化判断与物质状态间的关系,答题时注意审题,题目难度中等.

| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
| A. | 电解池,阳极Pt,阴极用Cu,纯水做电解液 | |
| B. | 原电池,负极用Cu,正极用石墨,氯化钠溶液做电解液 | |
| C. | 电解池,阳极用Cu,阴极用石墨,H2SO4做电解液 | |
| D. | 电解池,阳极用Cu,阴极用石墨,Na2SO4做电解液 |
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量=(填“>”“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,则:
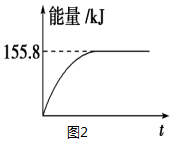
①能表示该反应过程中能量变化的是(图1)D(填字母).

②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图2所示,则CH4的转化率为63%.
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H=-74.8kJ•mol-1.
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是C(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
(5)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
A.v正(H2)=2v逆(CH3OH) B.n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
②下列说法正确的是AC.
A.c1=c2 B.Q1=Q2 C.K1=K2 D.α2+α3<100%
③如图表示该反应的反应速率v和时间t的关系图(图3):
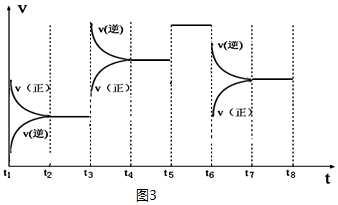
各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)-58.7 | I2-184.0 |
| ③ | (e)-19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O-100.0 | H2S-60.0 | (d)-42 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、c的化学式分别为Ne2、Br2、HF | |
| B. | 第②组物质均有氧化性;第③组物质对应水溶液均是强酸 | |
| C. | 第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te | |
| D. | 上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
 →
→
 .
. 的名称为2,2,6-三甲基-4-乙基辛烷.
的名称为2,2,6-三甲基-4-乙基辛烷. 的名称为3-甲基-2-乙基-1-戊烯.
的名称为3-甲基-2-乙基-1-戊烯.