题目内容
3.填空题I.(1)比较原子半径的大小:O>F;(填“>”或“<”,下同)
(2)比较酸性强弱:H3PO4>H2SiO3
(3)稳定性:NH3>PH3
II.写出下列物质形成过程的电子式:
(4)HClH•+
 →
→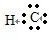
(5)MgCl2
 .
.
分析 I.(1)同周期元素从左到右,原子半径逐渐减小;
(2)元素的非金属性越强,对应的最高价氧化物的酸性越强;
(3)元素的非金属性越强,对应的氢化物越稳定;
II.(4)氯化氢为共价化合物;
(5)氯化镁为离子化合物.
解答 解:I.(1)同周期元素从左到右,原子半径逐渐减小,则原子半径O>F,故答案为:>;
(2)非金属性P>Si,元素的非金属性越强,对应的最高价氧化物的酸性越强,故答案为:>;
(3)非金属性N>P,元素的非金属性越强,对应的氢化物越稳定,故答案为:>;
II.(4)氯化氢为共价化合物,其形成过程是:H•+ →
→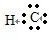 ,故答案为:H•+
,故答案为:H•+ →
→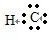 ;
;
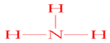
(5)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期律知识以及电子式的书写,为高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意把握元素周期率的递变规律以及性质的比较角度,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)已知:
①NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化生成NO的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+3O2=2N2+6H2O.已知电解质溶液为KOH溶液,则负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如表:
①由上表数据可知该反应的△H< 0 填“>”、“<”或“=”);
②理论上,为了增大平衡时H2的转化率,可采取的措施是AD(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、l mol•L-1,此时刻该反应的V正(N2)=< V逆(N2).(填“>”、“<”或“=”).
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38,Ksp[Al(OH)3]=4.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol•L-1时,可以认为沉淀完全.在含Fe3+、A13+的浓度均为1.05mol•L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数70%.
(1)已知:
①NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化生成NO的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+3O2=2N2+6H2O.已知电解质溶液为KOH溶液,则负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是AD(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、l mol•L-1,此时刻该反应的V正(N2)=< V逆(N2).(填“>”、“<”或“=”).
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38,Ksp[Al(OH)3]=4.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol•L-1时,可以认为沉淀完全.在含Fe3+、A13+的浓度均为1.05mol•L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数70%.
14.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 工业制漂白粉:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 将氯气溶于水制备次氯酸:C12+H2O═2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
11.下列说法错误的是( )
| A. | 氢是原子半径最小的元素 | |
| B. | 氟是非金属性最强的元素 | |
| C. | 硅元素适合作半导体材料 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
15.根据如图能量变化曲线判断,下列说法正确的是( )


| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |
16.下列说法正确的是( )
| A. | 在0.1mol•L-1的碳酸钠溶液中存在5种微粒,且c(CO32-)+c(HCO3-)=0.1mol•L-1 | |
| B. | 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH- | |
| C. | FeSO4溶液中滴加次氯酸钠溶液:Fe2++ClO-+2H2O=Fe(OH)2↓+2HClO | |
| D. | AgNO3溶液中滴加足量NaCl溶液,再滴加NaI溶液,先产生白色沉淀后转化为黄色沉淀 |
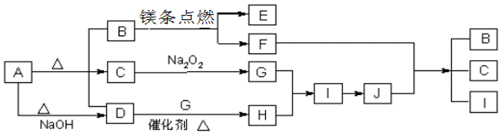
 .
.
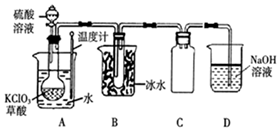 二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)
二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)