题目内容
8.CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量=(填“>”“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是(图1)D(填字母).

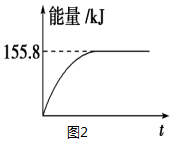
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图2所示,则CH4的转化率为63%.
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H=-74.8kJ•mol-1.
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是C(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
(5)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
A.v正(H2)=2v逆(CH3OH) B.n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
②下列说法正确的是AC.
A.c1=c2 B.Q1=Q2 C.K1=K2 D.α2+α3<100%
③如图表示该反应的反应速率v和时间t的关系图(图3):
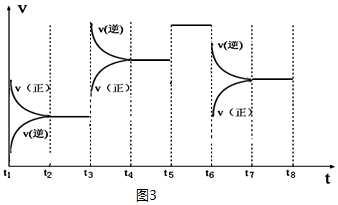
各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
分析 (1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890,.3kJ•mol-1,得到甲烷细菌使1mol甲烷生成CO2气体与液态水放出的热量;
(2)①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量,反应为放热反应,据此分析图象判断;
②依据①计算得到的反应的焓变,图中中是反应达到平衡状态时放热155.8KJ,计算反应的甲烷得到转化率;
(3)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
反应C(石墨,s)+2H2(g)=CH4(g)可以是②+③-①得到,由此分析解答;
(4)A.CO2与H2O反应生成CH4和O2,为吸热反应;
B.使CO2分解生成碳与O2的反应为吸热反应,常温下不能发生;
C.大气中的CO2和海底开采的CH4合成合成气(CO、H2),具有可行性;
D.将固态碳合成C60,以C60作燃料,产物相同;
(5)①可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
②在恒温恒容条件下,甲加入1molCO、2molH2与乙中1molCH3OH为等效平衡,而丙中加入2molCO、4molH2,与甲相比,丙增大了压强,平衡向着正向移动,据此进行解答;
③温度不变,化学平衡常数不变,t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应该为升高了温度;t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动,据此进行解答.
解答 解:(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,得到甲烷细菌使1mol甲烷生成CO2气体与液态水放出的热量等于890.3kJ•mol-1,
故答案为:=;
(2)①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量=15.46KJ×16=247.36KJ,反应焓变△H=-247.36KJ/mol,反应为放热反应,反应物能量高于生成物,反应的热化学方程式为:CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=-247.36KJ/mol,符合能量变化的图象只有D符合,
故答案为:D;
②反应的热化学方程式为:CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=-247.36KJ/mol,图象可知反应达到平衡状态放出热量155.80KJ,则反应的甲烷物质的量=$\frac{155.80KJ}{247.36KJ/mol}$=0.63mol,甲烷转化率为63%,
故答案为:63%;
(3)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
盖斯定律计算,②+③-①得到,反应C(石墨,s)+2H2(g)=CH4(g)△H=-74.8 kJ•mol-1,
故答案为:-74.8 kJ•mol-1;
(4)A.甲烷与氧气的反应为放热反应,可知CO2与H2O反应生成CH4和O2为吸热反应,故A错误;
B.使CO2分解生成碳与O2的反应为吸热反应,常温下不能发生,故B项不正确;
C.大气中的CO2和海底开采的CH4合成合成气(CO、H2),具有可行性,利用优质催化剂、太阳能实现转化,故C正确;
D.将固态碳合成C60,以C60作燃料,产物相同,研究方向不可行,故D错误;
故答案为:C;
(5)①A.v正(H2)=2v逆(CH3OH),表示的是正逆反应速率,且满足二者计算量关系,说明反应达到平衡状态,故A错误;
B.n(CO):n(H2):n(CH3OH)=1:2:1,物质的量之比,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故B正确;
C.混合气体的密度不变,反应前后都是气体,容器的容积不变,所以气体的密度始终不变,密度不能作为判断平衡状态的依据,故C正确;
D.该反应是气体体积缩小的反应,反应过程中气体的物质的量发生变化,混合气体的平均分子量发生变化,若混合气体的平均相对分子质量不变,说明达到了平衡状态,故D错误;
E.该反应是体积缩小的反应,气体的物质的量在反应中发生变化,若容器的压强不变,说明正逆反应速率相等,达到了平衡状态,故E错误;
故答案为:BC;
②A、恒温恒容条件下,甲加入1molCO、2molH2与乙中1molCH3OH为等效平衡,则达到平衡时各组分的浓度都相等,所以c1=c2,故A正确;
B、由于甲和乙是从不同方向进行的反应,则甲放出的热量与乙吸收的热量不一定相等,故B错误;
C、由于甲和乙为从不同的方向进行的可逆反应,两个反应中温度相同,则平衡常数不变,所以K1=K2,故C正确;
D、甲和乙为等效平衡,反应的方向完全不同,所以a1=a2,用于丙中浓度为甲的2倍,相当于增大了压强,丙中反应物转化率大于甲,即a3>a1,所以a2+a3>100%,故D错误;
故答案为:AC;
③t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应为升高温度,所以K4>K5;
t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动;应为降低压强,所以K6=K7;
t5~t6正逆速率都增大,平衡不移动,应是使用催化剂,K不变,所以K5=K6,所以K4>K5=K6=K7,
根据t3时刻升高了温度,平衡向着逆向移动,反应物转化率减小;t4-t5时使用催化剂,转化率不变;t6时减小了压强,平衡向着逆向移动,反应物转化率减小,所以t2~t3段A的转化率最高,
故答案为:K4>K5=K6=K7; t2~t3.
点评 本题考查了热化学方程式书写、盖斯定律计算、反应热与能源,为高频考点,把握物质的性质、反应中的能量变化、化学研究等为解答的关键,侧重分析与应用能力的考查,注意化学研究方案的可行性分析,题目难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 工业制漂白粉:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 将氯气溶于水制备次氯酸:C12+H2O═2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |

| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |
| A. | 在0.1mol•L-1的碳酸钠溶液中存在5种微粒,且c(CO32-)+c(HCO3-)=0.1mol•L-1 | |
| B. | 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH- | |
| C. | FeSO4溶液中滴加次氯酸钠溶液:Fe2++ClO-+2H2O=Fe(OH)2↓+2HClO | |
| D. | AgNO3溶液中滴加足量NaCl溶液,再滴加NaI溶液,先产生白色沉淀后转化为黄色沉淀 |
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器①中反应的平衡常数K=1.某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正小于V逆(填大于,小于或等于)
(4)下列叙述正确的是ad(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
①Al2O3(S)+3C(S)═2Al(S)+3CO(g)△H1═+1344.1KJ•mol-1
②2AlCl3(g)═2Al(S)+3Cl2(g)△H2═+1169.2KJ•mol-1
③Al2O3(g)+3C(S)+3Cl2(g)═2AlCl3(g)+3CO(g)△H3═+QKJ•mol-1
下列有关说法正确的是( )
| A. | 反应①中化学能转化为热能 | |
| B. | 反应②中若生成液态铝则反应热应大于△H2 | |
| C. | 反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量 | |
| D. | 该生产工艺中能循环利用的物质只有A1C13 |
①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-178kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-41.2kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
已知反应①中相关的化学键键能数据如下:
| 化学键 | C-C | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 463 |
| A. | 1550+43.2kJ•mol-1 | B. | 750-43.2kJ•mol-1 | ||
| C. | 1550+86.4kJ•mol-1 | D. | 750+43.2kJ•mol-1 |
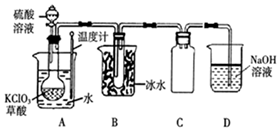 二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)
二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略) 配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).
配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).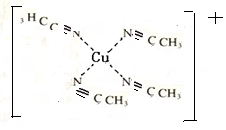 (不考虑空间构型).
(不考虑空间构型).