题目内容
11.用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$2Cl2+2H2O(1)已知:Ⅰ、反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ、

①反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.
②断开1mol H-O 键与断开 1mol H-Cl 键所需能量相差约为32kJ,H2O中H-0 键比HCl中H-Cl键(填“强”或“弱”)强.
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率.某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况).该合成氨厂N2的转化率为25%.
分析 (1)①反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
②反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差;
(2)先根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算反应前混合气体中N2和H2的体积比,然后根据M=ρVm=$\frac{m}{n}$求出转化率.
解答 解:(1)①依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
②E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol;故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,所以H2O中H-O 键比HCl中H-Cl键强;
故答案为:32;强;
(2)设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1-x),依题意得:
28x+2(1-x)=0.5536×22.4 解得x=0.4
所以N2、H2的物质的量之比为2:3
设起始N2的物质的量为2mol,H2为3 mol,N2的转化量为y
N2 +3H2 ?2NH3
起始(mol) 2 3 0
转化(mol) y 3y 2y
平衡(mol) 2-y 3-3y 2y
总物质的量=2-y+3-3y+2y=(5-2y)mol
$\frac{(28×2+2×3)}{(5-2y)}$=0.693×22.4(左右都是反应后气体的摩尔质量)
y=0.5 mol
所以N2的转化率为$\frac{0.5}{2}$×100%=25%,
故答案为:25%.
点评 本题考查了焓变等于反应物的键能和减去生成物的键能和、热化学方程式的书写,以及混合物计算注意利用三段式解答,题目难度中等.

| A. | 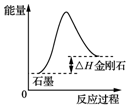 由图可知,从能量角度考虑,金刚石比石墨稳定 | |
| B. | 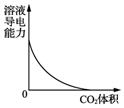 图表示CO2通入饱和Na2CO3溶液中,溶液导电能力的变化 | |
| C. | 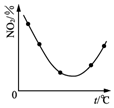 图表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 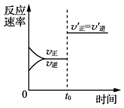 图表示某可逆反应的反应速率随时间的变化,t0时刻改变的条件一定是使用了催化剂 |

| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |
| A. | 在0.1mol•L-1的碳酸钠溶液中存在5种微粒,且c(CO32-)+c(HCO3-)=0.1mol•L-1 | |
| B. | 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH- | |
| C. | FeSO4溶液中滴加次氯酸钠溶液:Fe2++ClO-+2H2O=Fe(OH)2↓+2HClO | |
| D. | AgNO3溶液中滴加足量NaCl溶液,再滴加NaI溶液,先产生白色沉淀后转化为黄色沉淀 |
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器①中反应的平衡常数K=1.某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正小于V逆(填大于,小于或等于)
(4)下列叙述正确的是ad(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-178kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-41.2kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
已知反应①中相关的化学键键能数据如下:
| 化学键 | C-C | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 463 |
| A. | 1550+43.2kJ•mol-1 | B. | 750-43.2kJ•mol-1 | ||
| C. | 1550+86.4kJ•mol-1 | D. | 750+43.2kJ•mol-1 |
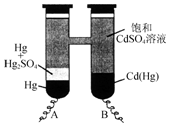 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )| A. | 电池工作时Cd2+向电极B移动 | |
| B. | 电极A上发生的反应:Hg2SO4+2e-═2Hg+SO42- | |
| C. | 电极B上发生的反应:Cd(Hg)-4e-═Hg2++Cd2+ | |
| D. | 反应中每生成a mol Hg转移3a mol电子 |
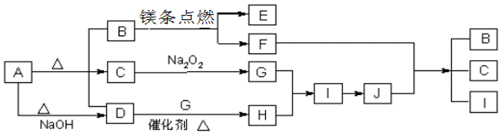
 .
.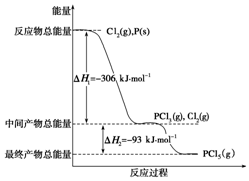 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题: