题目内容
5.新制氯水中存在平衡:Cl2+H2O?HCl+HClO若向氯水中投入少量CaCO3粉末,则( )| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
分析 在下列平衡:C12+H2O?H++C1-+HC1O,若向氯水中加入少量CaCO3粉末,会和溶液中的盐酸反应平衡正向进行,由此分析解答.
解答 解:在化学平衡中:C12+H2O?H++C1-+HC1O,若向氯水中加入少量CaCO3粉末,会和溶液中的盐酸反应平衡正向进行,Cl2的转化率增大,H+浓度减小,次氯酸酸性小于碳酸,不与碳酸钠反应,次氯酸浓度增大,
故选BD.
点评 本题考查了氯水中的化学平衡,主要考查次氯酸酸性小于碳酸,不与碳酸钙反应.

练习册系列答案
相关题目
16.下列现象与氢键无关的是( )
| A. | HF的熔、沸点比ⅦA族其他元素氢化物的高 | |
| B. | 水分子高温下也很稳定 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | NH3极易溶于水 |
13.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)已知:
①NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化生成NO的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+3O2=2N2+6H2O.已知电解质溶液为KOH溶液,则负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如表:
①由上表数据可知该反应的△H< 0 填“>”、“<”或“=”);
②理论上,为了增大平衡时H2的转化率,可采取的措施是AD(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、l mol•L-1,此时刻该反应的V正(N2)=< V逆(N2).(填“>”、“<”或“=”).
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38,Ksp[Al(OH)3]=4.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol•L-1时,可以认为沉淀完全.在含Fe3+、A13+的浓度均为1.05mol•L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数70%.
(1)已知:
①NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化生成NO的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+3O2=2N2+6H2O.已知电解质溶液为KOH溶液,则负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是AD(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、l mol•L-1,此时刻该反应的V正(N2)=< V逆(N2).(填“>”、“<”或“=”).
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38,Ksp[Al(OH)3]=4.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol•L-1时,可以认为沉淀完全.在含Fe3+、A13+的浓度均为1.05mol•L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数70%.
20.如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )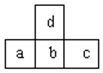

| A. | d的氢化物比b的氢化物稳定 | |
| B. | d与c不能形成化合物 | |
| C. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| D. | 原子半径的大小顺序是a>b>c>d |
10.短周期元素X、Y、Z、W的原子序数依次增大.X有三种核素,其中两种可用于制造核弹;Z 与W在周期表中同主族,且Y、Z、W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.下列叙述错误的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 2.24 L(标准状况)M溶于1 L水中,所得溶液的pH约为13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | Y、W的最髙价氧化物对应的水化物均为强酸 |
17.下列图示与对应的叙述相符合的是(( )
| A. | 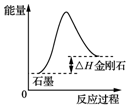 由图可知,从能量角度考虑,金刚石比石墨稳定 | |
| B. | 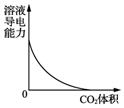 图表示CO2通入饱和Na2CO3溶液中,溶液导电能力的变化 | |
| C. | 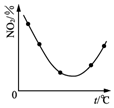 图表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 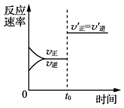 图表示某可逆反应的反应速率随时间的变化,t0时刻改变的条件一定是使用了催化剂 |
14.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 工业制漂白粉:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 将氯气溶于水制备次氯酸:C12+H2O═2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
15.根据如图能量变化曲线判断,下列说法正确的是( )


| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |