题目内容
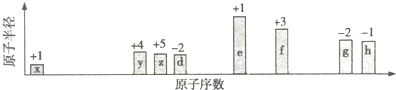
11.A、B、C、D、E为原子序数依次增大的短周期元素.D是地壳中含量最高的金属元素; A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝;A、C处于同一主族,E原子的最外层电子数是A、B、C原子最外层电子数之和.E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),已知化合物乙是盐.请回答下列问题:(1)甲的化学式为NH3;B单质的电子式为
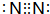 .
.(2)D元素是铝.
(3)乙的化学式为NH4Cl,请用离子方程式说明乙溶液显酸性的原因:NH4++H2O?NH3•H2O+H+.
(4)请写出实验室制E单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 A、B、C、D、E为原子序数依次增大的短周期元素.D是地壳中含量最高的金属元素,则D为Al;A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝,该气体甲为NH3,则A为H元素、B为N元素;A、C处于同一主族,则C为Na,E原子的最外层电子数是A、B、C原子最外层电子数之和,则E原子最外层电子数为1+5+1=7,故E为Cl;E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),则乙为NH4Cl、丙为HCl,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期元素.D是地壳中含量最高的金属元素,则D为Al;A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝,该气体甲为NH3,则A为H元素、B为N元素;A、C处于同一主族,则C为Na,E原子的最外层电子数是A、B、C原子最外层电子数之和,则E原子最外层电子数为1+5+1=7,故E为Cl;E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),则乙为NH4Cl、丙为HCl,
(1)甲的化学式为NH3,B单质为N2,电子式为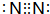 ,故答案为:NH3;
,故答案为:NH3;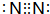 ;
;
(2)D元素的是铝,故答案为:铝;
(3)乙为NH4Cl,铵根离子水解导致溶液显示酸性,离子方程式为NH4++H2O?NH3•H2O+H+,故答案为:NH4Cl;NH4++H2O?NH3•H2O+H+;
(4)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查结构性质位置关系应用,涉及元素化合物性质、电子式、盐类水解分析应用等知识,是对学生综合能力的考查,侧重于元素化合物知识的综合理解和运用的考查,比较基础,注意基础知识的掌握,难度不大.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 氧族元素包括氧、硫、锡、碲、钋 | |
| B. | Na2O2固体中的阳离子和阴离子个数比为1:1 | |
| C. | H、D、T、H+可以用来表示氢元素的四种同位素 | |
| D. | 表示金属元素名称的汉字不一定都含“钅”旁 |
| A. | 只含非极性键的纯净物一定是单质 | B. | 只含极性键的纯净物一定是化合物 | ||
| C. | 离子化合物中一定有离子键 | D. | 纯净物中一定存在化学键 |
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 甲烷、乙烯和苯的分子中原子都在同一平面上 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | 乙烯和甲烷不能用溴的四氯化碳溶液鉴别 |
| A. | 热稳定性:HF>HCl>H2Se | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:I->Se2->Cl- | D. | 酸性:HBrO4>H2SeO4>HClO4 |
| A. | 碱金属钠、钾保存在煤油中 | |
| B. | 液溴应用水封保存在带橡胶塞的细口瓶中 | |
| C. | 氢氟酸、氯水、AgNO3溶液保存在棕色玻璃瓶中 | |
| D. | 盛Na2SiO3溶液的试剂瓶应用橡胶塞 |
| A. | PCl3属于离子晶体 | B. | PCl3中心磷原子为sp2杂化 | ||
| C. | PCl3分子属于非极性分子 | D. | PCl3水解可以生成盐酸 |



 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).
 .
.