题目内容
3.已知PCl3的熔点为-93.6°C,沸点为76.1℃,露置于空气中有白雾生成.下列叙述正确的是( )| A. | PCl3属于离子晶体 | B. | PCl3中心磷原子为sp2杂化 | ||
| C. | PCl3分子属于非极性分子 | D. | PCl3水解可以生成盐酸 |
分析 由PCl3的熔点为-93.6°C,沸点为76.1℃,熔沸点低所以三氯化磷是分子晶体,PCl3与水反应生成盐酸和磷酸,由此分析解答.
解答 解:A、熔沸点低所以三氯化磷是分子晶体,故A错误;
B、PCl3中心磷原子与三个氯形成三个σ键,外围还有一对孤电子对,所以P为sp3杂化,故B错误;
C、PCl3分子是三角锥形,正负电荷中心不重合,属于极性分子,故C错误;
D、PCl3与水反应生成盐酸和磷酸,故D正确;
故选D.
点评 本题考查晶体的类型、杂化方式、分子的极性和双水解的相关知识,综合性较强,但比较容易.

练习册系列答案
相关题目
14.下列有关有机物结构的说法中正确的是( )
| A. | CH2═CH2分子中6个原子都共面,而CH3CH═CH2分子中最多有7个原子共面 | |
| B. | 苯是平面正六边形分子,其中存在单双键交替的结构 | |
| C. | 正戊烷分子中的碳原子之间以碳碳单键结合成直线状 | |
| D. | CH3Cl没有同分异构体说明CH4是正四面体结构,而非平面正方形 |
15.研究发现,NO在人体的血管系统内具有传送信号的功能,因而有“信使分子”的誉称.下列有关NO的说法正确的是( )
| A. | NO不属于大气污染物 | B. | NO能溶于水 | ||
| C. | NO易与空气中的氧气化合 | D. | NO可用排空气法收集 |
12.元素周期表和元素周期律的有关说法,正确的是( )
| A. | 原子最外层电子数≥4的金属元素有6种,元素符号分别是Ge Sn Pb Te Bi Po | |
| B. | 过渡元素全部属于副族元素,全部都是金属元素,它们位于周期表第3纵行至第12纵行 | |
| C. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为1或2 | |
| D. | 在元素周期表中位于ⅡB族左右两列元素分别是ⅠB和ⅢB |
13.化学科学需要借助化学语言来描述.下列化学用语正确的是( )
| A. | 甲烷分子的球棍模型: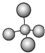 | |
| B. | $\underset{\stackrel{1}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$、$\underset{\stackrel{2}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$为同素异形体 | |
| C. | 离子结构示意图 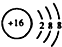 可以表示32S2-,又可以表示34S2- 可以表示32S2-,又可以表示34S2- | |
| D. | 中子数为146、质子数为92的铀(U)原子 14692U |
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素. ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族. ,R、T的氢化物的稳定强的HCl(填化学式)
,R、T的氢化物的稳定强的HCl(填化学式) .
.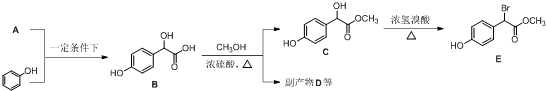
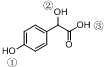 中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式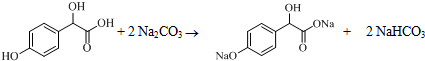 .
.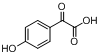 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$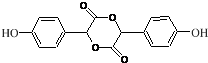 +2H2O.
+2H2O.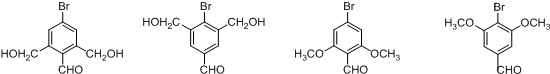 (不考虑立体异构).
(不考虑立体异构).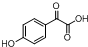 的合成路线图.
的合成路线图.
 .
. .
. .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O.