题目内容
11.氢气是合成氨的重要原料.(1)①已知:CH4(g)+H2O(g)═CO (g)+3H2(g)△H=206.2 kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4 kJ•mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法.则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1.
②如果要提高单位时间内合成氢气的产量,下列措施中可行的是ACD
A、增大水蒸气浓度 B、降低压强 C、升高温度 D、使用某种合适的催化剂.
分析 ①利用盖斯定律解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得;
②根据影响化学反应速率、化学平衡的影响条件分析判断,升温、增大压强、加入催化剂、增大浓度都可以增大反应速率,平衡向正向进行,增大另一种物质的浓度会提高氢气转化率.
解答 解:①a CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kmol-1
b CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJmol-1
据盖斯定律,a×2-b得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1;
②A、增大水蒸气浓度,平衡正向移动,氢气产量增大,故A正确;
B、降低压强,反应速率减慢,故B错误;
C、升高温度,平衡正向移动,反应速率加快,氢气产量提高,故C正确;
D、使用某种合适的催化剂,加快化学反应速率,单位时间被氢气产量提高,故D正确.
故选:ACD.
点评 本题考查了热化学方程式的书写,盖斯定律得应用,影响化学反应速率、化学平衡的因素的分析,化学平衡移动原理的应用是解题关键,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
19.当温度不变时,恒容的容器中进行反应2A?B,若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20秒,那么由0.06mol•L-1降到0.036mol•L-1,所需反应的时间为( )
| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
16.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 铁表而镀铜可以增强其抗腐蚀性 | |
| B. | 用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+$\frac{y}{4}$)O2$→_{高温}^{催化剂}$xCO2+$\frac{y}{2}$H2O | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 废旧电池中含有的重金属离子对水和土壤会造成污染,因而不能随意丢弃 |
3.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )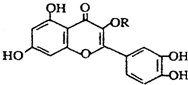

| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7molBr2完全反应 |
20.下列说法正确的是( )
| A. | 32 g 18O2中含有的氧原子数是2×6.02×1023 | |
| B. | 1 mol N2和CO的混合气体中含有的分子总数是2×6.02×1023 | |
| C. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023 | |
| D. | 1.0 L 0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |
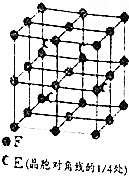 A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.
A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.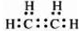 .
.
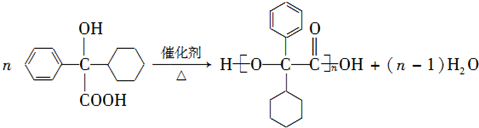 .
.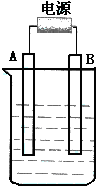 如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:
如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题: