题目内容
19.当温度不变时,恒容的容器中进行反应2A?B,若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20秒,那么由0.06mol•L-1降到0.036mol•L-1,所需反应的时间为( )| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
分析 随着反应物浓度的减小,化学反应速率减慢,反应所需时间增多,依此解答.
解答 解:反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20s,即反应物的浓度变化为0.1-0.06=0.04mol•L-1,
反应物的浓度由0.06mol•L-1降到0.036mol•L-,即反应物的浓度变化为0.06-0.036=0.024mol•L-1,若反应速率不变,则所需时间为$\frac{0.024}{0.04}$=12s,但随着浓度的减小,反应速率逐渐减小,故所需时间大于12s,
故选C.
点评 本题考查难度对化学反应速率的影响,注意化学反应速率概念的计算应用,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
9.下列反应中不可能设计成原电池的是( )
| A. | NaOH+HCl═NaCl+H2O | B. | 2Fe3++Fe═3Fe2+ | ||
| C. | Zn+2HCl═ZnCl2+H2↑ | D. | 4Al+3O2+6H2O═4Al(OH)3↓ |
10.一种熔融碳酸盐燃料电池原理示意如图.
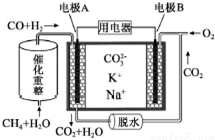
下列有关该电池的说法不正确的是( )

下列有关该电池的说法不正确的是( )
| A. | 电极A上H2参与的电极反应为:CO+H2+2CO32--4e-=3CO2+H2O | |
| B. | 理论上,A极每消耗1molH2,则消耗$\frac{1}{3}$molCH4 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
7.下列反应原理不符合工业冶炼金属实际情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ |
14.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | 钠的金属活动性排在铜前面,所以金属钠可以置换出硫酸铜溶液中的铜 | |
| B. | 铁制容器盛放和运输浓硫酸 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物.可用于水的净化 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
9.下列化学反应不能设计成实用电池是( )
| A. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | B. | 2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ | ||
| C. | 2CO+O2═2CO2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
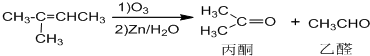
 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.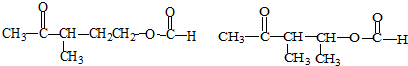
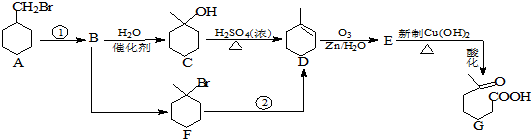
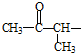 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应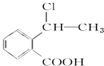 为原料制备
为原料制备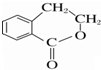 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.