��Ŀ����
20������˵����ȷ���ǣ�������| A�� | 32 g 18O2�к��е���ԭ������2��6.02��1023 | |
| B�� | 1 mol N2��CO�Ļ�������к��еķ���������2��6.02��1023 | |
| C�� | 2.3 g Na��O2��ȫ��Ӧ����3.6 g����ʱʧ��������0.1��6.02��1023 | |
| D�� | 1.0 L 0.1 mol•L-1 NH4NO3��Һ�к��е�笠���������0.1��6.02��1023 |
���� A��18O2��Ħ������Ϊ36g/mol��
B��������N=nNA��
C������Ƶ����ʵ�����Ȼ������ƺ�������Ӧ���Ϊ+1����������
D��笠�����Ϊ���������ӣ�����Һ�л�ˮ�⣮
��� �⣺A��18O2��Ħ������Ϊ36g/mol����32g���������ʵ���С��1mol�����е���ԭ����С��2NA������A����
B��������N=nNA=1mol��NA/mol=NA����B����
C��2.3g�Ƶ����ʵ���Ϊ0.1mol�����ƺ�������Ӧ���Ϊ+1�ۣ���0.1mol��ʧȥ0.1NA�����ӣ���C��ȷ��
D��笠�����Ϊ���������ӣ�����Һ�л�ˮ�⣬����Һ��笠����ӵĸ���С��0.1NA������D����
��ѡC��
���� ���⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ����ѶȲ���

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
10��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ��

�����йظõ�ص�˵������ȷ���ǣ�������

�����йظõ�ص�˵������ȷ���ǣ�������
| A�� | �缫A��H2����ĵ缫��ӦΪ��CO+H2+2CO32--4e-=3CO2+H2O | |
| B�� | �����ϣ�A��ÿ����1molH2��������$\frac{1}{3}$molCH4 | |
| C�� | ��ع���ʱ��CO32-��缫A�ƶ� | |
| D�� | �缫B�Ϸ����ĵ缫��ӦΪ��O2+2CO2+4e-=2CO32- |
15��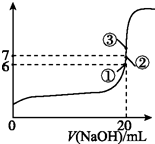 ����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��1����֪25��ʱ����HF��aq��+OH-��aq���TF-��aq��+H2O��l����H=-67.7 kJ/mol��
��H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol��
�����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪHF��aq��?H+��aq��+F-��aq����H=-10.4kJ•mol-1��
��2����Ũ��Ϊ0.1 mol/L HF��Һ��ˮϡ��һ���������¶Ȳ��䣩�����и����������CD��
A��c��H+��������������������������������B��c��H+��•c��OH-��
C��$\frac{c��{H}^{+}��}{c��{H}^{-}��}$������������������������������D��$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$
��3����20 mL 0.1 mol/L������м���V mL 0.1 mol/L NaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����BC��
A��pH=3��HF��Һ��pH=11��NaF��Һ�У���ˮ�������c��H+�����
B���ٵ�ʱpH=6����ʱ��Һ�У�c��F-��-c��Na+��=9.9��10-7mol/L
C���ڵ�ʱ����Һ�е�c��F-��=c��Na+��
D���۵�ʱV=20 mL����ʱ��Һ��c��F-����c��Na+��=0.1 mol/L
��4�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L������������Һ����Na2CO3��Һ����NaHCO3��Һ����NaF��Һ��NaClO��Һ�����������ж�pH�ɴ�С��˳���Ǣ٣��ܣ��ڣ��ۣ�
��5��Na2CO3��Һ�Լ�������ΪCO${\;}_{3}^{2-}$ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤��֮��̼������Һ�е����̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ���dz��
��6������������һֱ��Ϊ���ĺ�������ڣ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH-O-F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A��ÿ����1 mol HFת��1mol���ӣ�
 ����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��| ��ѧʽ | HF | H2CO3 | HClO |
| ����ƽ�ⳣ����Ka�� | ��7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | ��3.0��10-8 |
��H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol��
�����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪHF��aq��?H+��aq��+F-��aq����H=-10.4kJ•mol-1��
��2����Ũ��Ϊ0.1 mol/L HF��Һ��ˮϡ��һ���������¶Ȳ��䣩�����и����������CD��
A��c��H+��������������������������������B��c��H+��•c��OH-��
C��$\frac{c��{H}^{+}��}{c��{H}^{-}��}$������������������������������D��$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$
��3����20 mL 0.1 mol/L������м���V mL 0.1 mol/L NaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����BC��
A��pH=3��HF��Һ��pH=11��NaF��Һ�У���ˮ�������c��H+�����
B���ٵ�ʱpH=6����ʱ��Һ�У�c��F-��-c��Na+��=9.9��10-7mol/L
C���ڵ�ʱ����Һ�е�c��F-��=c��Na+��
D���۵�ʱV=20 mL����ʱ��Һ��c��F-����c��Na+��=0.1 mol/L
��4�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L������������Һ����Na2CO3��Һ����NaHCO3��Һ����NaF��Һ��NaClO��Һ�����������ж�pH�ɴ�С��˳���Ǣ٣��ܣ��ڣ��ۣ�
��5��Na2CO3��Һ�Լ�������ΪCO${\;}_{3}^{2-}$ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤��֮��̼������Һ�е����̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ���dz��
��6������������һֱ��Ϊ���ĺ�������ڣ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH-O-F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A��ÿ����1 mol HFת��1mol���ӣ�
5����ͼ��ʾ���Ӧ����������ǣ�������
| A�� |  ����������Һ�ζ���Ũ�ȵ�A-��B-��C-�Ļ����Һ����������Ag+��Ӧ���ɳ���������ͼ��ȷ�����ȳ�������C- | |
| B�� |  ͼ��ʾ��Ӧ��ij��Ӧ��������淴Ӧ�������¶ȱ仯�������ͼ��֪�÷�Ӧ������Ӧ�����ȷ�Ӧ | |
| C�� |  һ�������£�X��Y��Ӧ����Z����ͼ1�Ƴ��÷�Ӧ�ķ���ʽ�ɱ�ʾΪ��X+3Y?Z | |
| D�� |  ͼ��ʾ��Һ�з�Ӧ��I2+I-?I3- ƽ��c��I3-�����¶ȱ仯����Ӧ�ٶ�V������M��V���棩N |
9�����л�ѧ��Ӧ������Ƴ�ʵ�õ���ǣ�������
| A�� | Cu+4HNO3�TCu��NO3��2+2NO2��+2H2O | B�� | 2NaOH+CuSO4�TNa2SO4+Cu��OH��2�� | ||
| C�� | 2CO+O2�T2CO2 | D�� | 2Al+2NaOH+2H2O�T2NaAlO2+3H2�� |
18���ζ����ǻ�ѧ�ϳ��õĶ��������ķ������ζ��ķ���������к͵ζ���������ԭ�ζ��������ζ�����ϵζ��ȣ�
��ѧ��ȤС��ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ������0.2000mol•L-1�ı�NaOH��Һ���еζ����ظ������ζ�����3�Σ�����¼���ݣ�
��1���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�B��������ţ�
A���ζ�����Һ��ı仯 B����ƿ����Һ��ɫ�ı仯
��2���жϵζ��յ�������ǣ���Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��
��3�������������ݣ���������������Һ��Ũ��Ϊ0.2000mol/L��
���һ�ѧ��ȤС������������ԭ��Ӧ�ζ����ⶨ��ij������ˮ������̬�ȵĺ�����ʵ�����£�
��ȡˮ��10.0ml����ƿ�У�����10.0ml��KI��Һ��������������ָʾ��2��3�Σ�
�ڽ��Լ����Ƶ�0.01mol•L-1��Na2S2O3��Һװ��ζ����У�����Һ�棬���¶�����
�۽���ƿ���ڵζ����½��еζ��������ķ�ӦΪ��I2+2Na2S2O3=2NaI+2Na2S4O6���Իش������ʴ�
��1������ٷ����Ļ�ѧ��Ӧ����ʽΪ��Cl2+KI=I2+2KCl�������ָʾ���ǵ�����Һ��
��2�������Ӧʹ�ü�ʽ�ζ��ܣ�
��3���ȵ�����Ũ�ȱ�ʵ��Ũ�Ȼ�ƫ���������ԭ�������ACE������ţ�
A ���Ʊ�Na2S2O3��Һ����ʱ����ˮ�����̶���
B ��ƿˮϴ��ֱ��װ����ˮ��
C װ��Na2S2O3��Һ�ĵζ���ˮϴ��û����ϴ
D �ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E �ζ�ǰ���첿�������ݣ��ζ�����ʧ
�����ζ����õ�ָʾ����������һ�ֳ���������֪һЩ���ε���ɫ��Ksp��20�棩���±����ⶨˮ�����Ȼ���ĺ��������ñ���������Һ���еζ���
��1���ζ�ʱ������Ϊ�õζ�����ѡ�õ�ָʾ���������е�D��������ţ�
A��KBrB��KIC��K2S D��K2CrO4
��2����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��$\frac{c��Br-��}{c��Cl-��}$=2.7��10-3��
��ѧ��ȤС��ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ������0.2000mol•L-1�ı�NaOH��Һ���еζ����ظ������ζ�����3�Σ�����¼���ݣ�
��1���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�B��������ţ�
A���ζ�����Һ��ı仯 B����ƿ����Һ��ɫ�ı仯
��2���жϵζ��յ�������ǣ���Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��
��3�������������ݣ���������������Һ��Ũ��Ϊ0.2000mol/L��
| �ζ����� | ����Һ�����mL�� | ��NaOH��Һ������¼��mL�� | |
| �ζ�ǰ���� | �ζ������ | ||
| ��һ�� | 20.00 | 0.40 | 20.40 |
| �ڶ��� | 20.00 | 4.00 | 24.00 |
| ������ | 20.00 | 2.00 | 24.10 |
��ȡˮ��10.0ml����ƿ�У�����10.0ml��KI��Һ��������������ָʾ��2��3�Σ�
�ڽ��Լ����Ƶ�0.01mol•L-1��Na2S2O3��Һװ��ζ����У�����Һ�棬���¶�����
�۽���ƿ���ڵζ����½��еζ��������ķ�ӦΪ��I2+2Na2S2O3=2NaI+2Na2S4O6���Իش������ʴ�
��1������ٷ����Ļ�ѧ��Ӧ����ʽΪ��Cl2+KI=I2+2KCl�������ָʾ���ǵ�����Һ��
��2�������Ӧʹ�ü�ʽ�ζ��ܣ�
��3���ȵ�����Ũ�ȱ�ʵ��Ũ�Ȼ�ƫ���������ԭ�������ACE������ţ�
A ���Ʊ�Na2S2O3��Һ����ʱ����ˮ�����̶���
B ��ƿˮϴ��ֱ��װ����ˮ��
C װ��Na2S2O3��Һ�ĵζ���ˮϴ��û����ϴ
D �ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E �ζ�ǰ���첿�������ݣ��ζ�����ʧ
�����ζ����õ�ָʾ����������һ�ֳ���������֪һЩ���ε���ɫ��Ksp��20�棩���±����ⶨˮ�����Ȼ���ĺ��������ñ���������Һ���еζ���
| ��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| ��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
| Ksp | 2.0��10-10 | 5.4��10-13 | 8.3��10-17 | 2.0��10-48 | 2.0��10-12 |
A��KBrB��KIC��K2S D��K2CrO4
��2����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��$\frac{c��Br-��}{c��Cl-��}$=2.7��10-3��
 +NaOH+2Cu��OH��2$\stackrel{����}{��}$
+NaOH+2Cu��OH��2$\stackrel{����}{��}$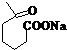 +Cu2O��+3H2O��
+Cu2O��+3H2O��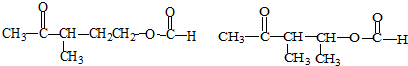
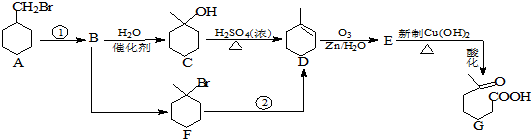
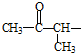 ���������� ���ܷ���������Ӧ
���������� ���ܷ���������Ӧ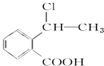 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�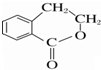 �ĺϳ�·������ͼ�����Լ����ã�����ע����Ӧ������
�ĺϳ�·������ͼ�����Լ����ã�����ע����Ӧ������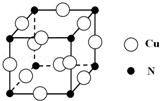 ��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺ ��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��
��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��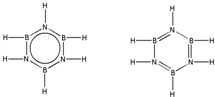 ��
��