题目内容
4.下列含有非极性键的极性分子是( )| A. | C2H5OH | B. | C2H2 | C. | HCOOH | D. | CH3OH |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A、C2H5OH含碳碳非极性键的极性分子,故A符合;
B、乙炔含C≡C非极性键、C-H极性键,为直线结构,属于非极性分子,故B不符合;
C、HCOOH不含非极性键的极性分子,故C不符合;
D、CH3OH不含非极性键的极性分子,故D不符合;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的判断、分子构型为解答的关键,侧重分析与应用能力的考查,注意分子构型与分子极性的关系,题目难度不大.

练习册系列答案
相关题目
15.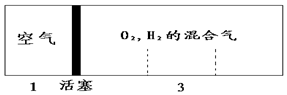 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )| A. | 1:2 | B. | 3:2 | C. | 5:2 | D. | 7:2 |
19.下列说法正确的是( )
| A. | HClO 中氯元素化合价比 HClO4 中氯元素化合价低,所以 HClO4 的氧化性强 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu; ②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 已知还原性 B->C->D-,反应 2C-+D2═2D-+C2 和 2C-+B2=2B-+C2 都能发生 | |
| D. | 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
7.下列各组溶液,只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的是( )
| A. | HCl和Na2CO3 | B. | 稀H2SO4和NaHCO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
8.下列说法中,正确的是( )
| A. | 在任何条件下,纯水的pH=7 | |
| B. | 盐类对水的电离都有促进作用 | |
| C. | 在95℃时,纯水的pH>7 | |
| D. | 在95℃时,纯水中H+的物质的量浓度c(H+)>10-7mol/L |