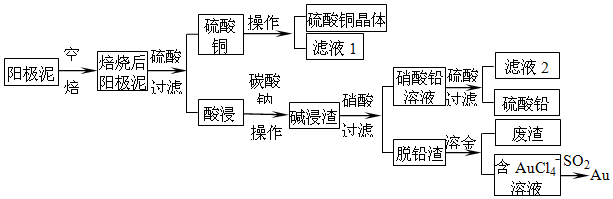
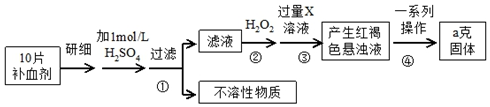
题目内容
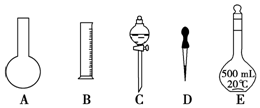
14.实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:①如图所示的仪器中,配制溶液肯定不需要的是AC (填序号),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒 (填仪器名称).
②配制0.1mol/L NaOH溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次)F E D C B A.
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
C.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制0.1mol/L NaOH溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液浓度小于0.1mol/L(填“大于”、“等于”或“小于”).
④配制0.5mol/L硫酸溶液500mL时,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6mL,用15mL量取(A.10ml B.15ml.C.20ml).
⑤配制0.5mol/L硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度大于0.5mol/L(填“大于”、“等于”或“小于”).
分析 ①根据配制一定物质的量浓度溶液用到仪器选择,仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶(500mL)、胶头滴管;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
③根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
④根据物质的量浓度计算c=$\frac{1000ρw%}{M}$然后依据稀释定律C浓•V浓=C稀•V稀进行分析;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
⑤用量筒量取浓硫酸时仰视刻度线导致浓硫酸的体积偏大.
解答 解:①配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有圆底烧瓶和分液漏斗,要配置450ml溶液应选择500ml容量瓶;还需用到的玻璃仪器有烧杯、玻璃棒,
故答案为:A C;烧杯、玻璃棒;
②操作步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,故答案为:F E D C B A;
③若定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度小于0.1mol/L;故答案为:小于;
④浓硫酸的物质的量浓度为c=$\frac{1000ρw%}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积是VmL,根据稀释定律C浓V浓=C稀V稀可知,
18.4mol/L×VmL=0.5mol•L-1×500mL,V=13.6mL;根据“大而近”的原则,根据需要量取的浓硫酸的体积为13.6mL可知应选择15mL的量筒,
故答案为:13.6; 15;
⑤用量筒量取浓硫酸时仰视刻度线导致浓硫酸的体积偏大,量取硫酸的物质的量偏大,依据c=$\frac{n}{V}$,可知溶液的浓度偏高,故答案为:大于.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

| A. |  | B. | 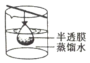 | C. |  | D. | 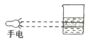 |
| A. | 500 mL溶液中的阴、阳离子总数为0.3NA | |
| B. | 500 mL溶液中NO3-离子浓度为0.2mol/L | |
| C. | 500 mL溶液中Ba2+离子浓度为0.2mol/L | |
| D. | 500 mL溶液中NO3-离子总数为0.2NA |
| A. | C2H5OH | B. | C2H2 | C. | HCOOH | D. | CH3OH |
 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯.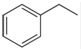 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol