题目内容
10.目前有效控制及高效利用CO、CO2的研究正引起全球广泛关注,根据《中国化工报》报道,美国科学家发现了几种新的可将CO、CO2转化为甲醇的高活性催化体系,比目前工业使用 的常见催化剂快近90倍.已知工业上可以利用CO2制备CH3OH涉及反应如下:
反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ/mol
反应II:CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
(1)写出工业上CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
(2)反应I能自发进行的条件是低温.
(3)一定温度下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据有C、E.
A.该反应的平衡常数不变 B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
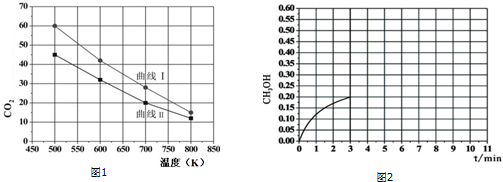
(4)500K,2L恒容密闭容器中充入3mol的H2和1.5molCO2仅发生反应I(左下图为实验过程中在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系图),该反应10min时CH3OH生成0.9mol,此时达到平衡:
①用氢气表示该反应的速率为0.135mol/(L•min).
②该温度下,反应I的平衡常数为200.
③在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图1所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min容器中CH3OH浓度的变化趋势曲线.
(5)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂发生上述反应,测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图2所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是C、E(选填编号)
A.改用高效催化剂 B.升高温度 C.缩小容器体积
D.分离出甲醇 E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”),其原因是反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)、一氧化碳制备甲醇:CO(g)+2H2(g)?CH3OH(g)均为放热反应,温度升高不利于CO2、CO转化为甲醇;反应II为吸热反应,温度升高使更多CO2转化为CO.综上所诉,CO的浓度一定增大..
分析 (1)准确写出一氧化碳与氢气反应生成甲醇的方程式,将已知的两个热化学方程式进行运算得到目标方程式,依据盖斯定律计算反应热;
(2)依据△H-T△S<0反应能自发进行判断解答;
(3)化学平衡状态的特征:等,即V正=V逆,定,即达到平衡后反应物、生成物物质的量,质量,浓度,百分含量等保持不变据此判断解答;
(4)①根据速率v=$\frac{△C}{△t}$结合三行式进行计算;
②化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
③将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(5)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动的因素都可以;
②根据反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO来回答.
解答 解:(1)把题中所给的两个热化学方程式分别记为①和②,
①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ/mol
②:CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
根据盖斯定律①-②得CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol;
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol;
(2)依据方程式:反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ/mol该反应能自发进行则满足:△H-T△S<0,△H<0、△S<0,故应该在低温下能自发进行;
故答案为:低温;
(3)A.温度不变,平衡常数不变,故不能作为判断平衡的标志,故A错误;
B.所指的速率都是表示正反应速率,且比例不对,不能作为判断平衡标志,故B错误;
C.该反应前后气体体积不相等,则压强不变说明达到平衡,故C正确;
D.反应物和产物都是气体,则气体总质量不变、容器体积不变,则密度始终不变,故D错误;
E.混合气体的总质量不变,但反应前后气体的物质的量不等,则平均相对分子质量不变说明达到平衡,故E正确;
故选:CE;
(4)在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.75 1.5 0 0
变化浓度:0.45 1.35 0.45 0.45
平衡浓度:0.3 0.15 0.45 0.45
①.氢气表示的反应速率=$\frac{1.35mol/L}{10min}$=0.135 mol•L-1•min-1,故答案为:0.135 mol•L-1•min-1;
②.该温度下,反应I的平衡常数K=$\frac{0.45×0.45}{0.3×0.1{5}^{3}}$=200,
故答案为:200;
③.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为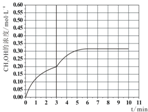 ,
,
故答案为: ;
;
(5)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动即可.
A.改用高效催化剂,能加快反应速率,但是不影响平衡的移动,故错误;
B.升高温度,加快反应速率且使得平衡逆向移动,不符合,故错误;
C.缩小容器体积,即增大压强,加快反应速率且使得平衡正向移动,故正确;
D.分离出甲醇,不能加快反应速率,故错误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,故正确.
故选CE;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大;反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,综上所述,CO的浓度一定增大.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.

| A. | C2H5OH | B. | C2H2 | C. | HCOOH | D. | CH3OH |
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见表:
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
| A. | 920 mL,107.64 g | B. | 500 mL,117 g | ||
| C. | 1000 mL,117.0g | D. | 任意规格,107.64 g |
| A. | 乙烯的结构式: | B. | 钠离子的结构示意图: | ||
| C. | 氢分子的电子式:H:H | D. | 氯化氢分子的电子式: |
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: