题目内容
9.常温下,通常用广泛PH试纸来测试溶液的酸碱性,如果被测试溶液的PH=4,则PH试纸显( )色.| A. | 白 | B. | 蓝 | C. | 红 | D. | 黄 |
分析 常温下,pH=7溶液呈中性,pH<7溶液显酸性,pH>7溶液显碱性,溶液显酸性时pH试纸显红色,溶液显碱性时,pH试纸显蓝色,据此解答.
解答 解:常温下,pH=7溶液呈中性,pH<7溶液显酸性,pH>7溶液显碱性,溶液显酸性时pH试纸显红色,溶液显碱性时,pH试纸显蓝色,
如果被测试溶液的PH=4,则pH<7溶液显酸性,pH试纸显红色,
故选:C.
点评 本题考查了溶液酸碱性与pH值之间的关系及pH试纸的使用方法,题目难度不大,掌握基础是解题关键.

练习册系列答案
相关题目
19.下列说法正确的是.( )
| A. | 在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有Fe2+ | |
| B. | 测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差 | |
| C. | 灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行 | |
| D. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点 |
20.在酸性溶液中,能大量共存的离子是( )
| A. | Al3+、Fe2+、Cl-、SO42- | B. | Mg2+、Fe3+、NO3-、SCN- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
4.25℃时相同浓度的下列溶液中,导电能力最强的是( )
| A. | H2O | B. | NH3•H2O | C. | CH3COOH | D. | NaCl |
8.在标准状况下,若vL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
| A. | $\frac{22.4}{Vn}$ | B. | $\frac{22.4n}{V}$ | C. | $\frac{Vn}{5.6}$ | D. | $\frac{5.6n}{V}$ |
 实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
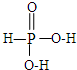 ,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.
,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.