题目内容
19.下列说法正确的是.( )| A. | 在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有Fe2+ | |
| B. | 测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差 | |
| C. | 灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行 | |
| D. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点 |
分析 A.滴加KSCN,无明显现象,再加氯水,看到溶液变为血红色,则亚铁离子被氧化生成铁离子;
B.pH试纸不能用水湿润;
C.物质的灼烧应放在坩埚中;
D.滴定未知浓度的氢氧化钠溶液时,反应终点在pH=7~8左右,选用酚酞作指示剂.
解答 解:A.滴加KSCN,无明显现象,再加氯水,看到溶液变为血红色,则亚铁离子被氧化生成铁离子,则说明原溶液中含有Fe2+,故A错误;
B.pH试纸不能用水湿润,否则可能会导致实验误差,故B错误;
C.物质的灼烧应放在坩埚中,不能放在蒸发皿中灼烧,故C错误;
D.滴定未知浓度的氢氧化钠溶液时,反应终点在pH=7~8左右,选用酚酞作指示剂,滴定终点与反应终点接近误差小,而选甲基橙作指示剂时与反应终点与滴定终点的差距大,则误差大,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、离子检验及仪器使用以及指示剂等,把握物质的性质、化学反应原理为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
9.某温度下重水中存在电离平衡D2O?D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析不正确的是( )
| A. | 0.1 mol NaOD溶于重水制成1L溶液,pD=11 | |
| B. | 将pD为4的DCl的重水溶液稀释10倍,所得溶液pD为5 | |
| C. | 向30 mL 0.5mol•L-1NaOD的重水溶液中加入20 mL 0.5 mol•L-1DCl的重水溶液,所得溶液pD=10 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
10.下列各组元素的第一电离能按递增的顺序正确的是( )
| A. | Na Mg Al | B. | B C N | C. | Si P As | D. | He Ne Ar |
7.NA为阿伏加德罗常数,下列正确的是( )
| A. | 80g硝铵含有氮原子数为2NA | |
| B. | 1L1mol•L-1的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA | |
| D. | 在铁与盐酸的反应中,铁的化合价显+3 |
4.某无色溶液X,由 Na+、Ag+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种离子组成,取溶液进行如图连续实验( )
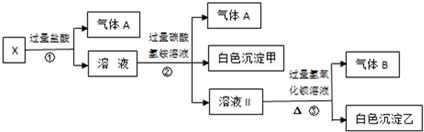

| A. | 气体A是CO2,白色沉淀甲是氢氧化铝 | |
| B. | 溶液中一定不含Ag+、Fe3+、SO42- | |
| C. | 溶液Ⅱ是硫酸钠、碳酸氢铵、氯化钠的混合物 | |
| D. | 溶液中一定存在的离子有Na+、CO32-、AlO2-和SO42- |
8.下列溶液一定呈酸性的是( )
| A. | 滴加酚酞显无色溶液 | B. | c(OH-)<c(H+)的溶液 | ||
| C. | pH<7的溶液 | D. | 滴加甲基橙显黄色溶液 |