题目内容
8.在标准状况下,若vL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )| A. | $\frac{22.4}{Vn}$ | B. | $\frac{22.4n}{V}$ | C. | $\frac{Vn}{5.6}$ | D. | $\frac{5.6n}{V}$ |
分析 根据n=$\frac{V}{{V}_{m}}$计算甲烷的物质的量,每个甲烷分子含有4个H原子,据此计算H原子的物质的量,再根据N=nNA计算阿伏加德罗常数.
解答 解:标准状况下,VL甲烷的物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
每个甲烷分子含有4个H原子,故H原子的物质的量为$\frac{V}{22.4}$mol×4=$\frac{V}{5.6}$mol,
故n=$\frac{V}{5.6}$mol×NA,解得NA=$\frac{5.6n}{V}$mol-1,
故选D.
点评 本题考查阿伏伽德罗常数,难度不大,理解掌握以物质的量为中心的有关计算,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
8.下列溶液一定呈酸性的是( )
| A. | 滴加酚酞显无色溶液 | B. | c(OH-)<c(H+)的溶液 | ||
| C. | pH<7的溶液 | D. | 滴加甲基橙显黄色溶液 |
16.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl->c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
3.根据表中的信息判断下列说法错误的是( )
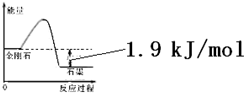
| 物质 | 外观 | 熔点 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色,透明固体 | ? | 395.4 |
| 石墨 | 灰黑,不透明固体 | ? | 393.5 |

| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-393.5kJ/mol |
13.甲醛、乙酸和葡萄糖组成的混合液中,碳元素的质量分数是( )
| A. | 27% | B. | 52% | C. | 40% | D. | 无法计算 |
20.下列化学用语正确的是( )
| A. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- | |
| B. | 氯化钠的电子式: | |
| C. | 甲烷的结构简式:CH4 | |
| D. | 14C的原子结构示意图: |
17.某无色溶液中,可大量共存的离子组是( )
| A. | Na+、CO32-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
18.某一混合物的无色水溶液,只可能含有以下离子中的若干种:Na+、K+、Cu2+、Ba2+、Cl-、CO32-、SO42-,现取2份100mL溶液进行如下实验:
(1)第一份溶液中加入硝酸银溶液,有沉淀生成;
(2)第二份溶液中加入足量的氯化钡溶液后,过滤、常温干燥得4.30g沉淀,经盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推断,正确的是( )
(1)第一份溶液中加入硝酸银溶液,有沉淀生成;
(2)第二份溶液中加入足量的氯化钡溶液后,过滤、常温干燥得4.30g沉淀,经盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推断,正确的是( )
| A. | Ba2+一定不存在,Cu2+可能存在 | |
| B. | 一定存在Cl- | |
| C. | 100 mL溶液中含有0.02 mol的CO32- | |
| D. | c(Na+)+c(K+)≥0.4 mol/L |