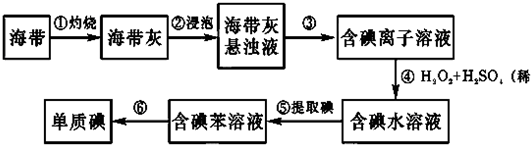
题目内容
11.已知氯仿通常是无色液体,不溶于水,密度约为水的1.5倍,沸点为61.2℃.要从水与氯仿的混合物中分离出氯仿,最合适的方法是( )| A. | 蒸馏 | B. | 分液 | C. | 重结晶 | D. | 过滤 |
分析 氯仿不溶于水,可用分液的方法从水与氯仿的混合物中分离出氯仿,以此解答该题.
解答 解:水与氯仿互不相溶,混合后会分层,互不相溶的两层液体分开要采用分液法,而蒸馏用于分离沸点不同的互溶混合物,过量用于分离固体和液体,重结晶用于分离溶解度不同的物质,
故选B.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同和常见物质的分离方法,难度不大.

练习册系列答案
相关题目
1.下列离子方程式书写不正确的是( )
| A. | Fe与HCl反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与AgNO3反应:2Ag++Cu═Cu2++2Ag | |
| C. | 醋酸与NaOH反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | CuSO4与Ba(OH)2反应:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓ |
19.常温下(25℃),已知H2SO3电离常数Ka1=1.4×10-2,Ka2=6.3×10-4,NH3•H2O的常数Kb=1.8×10-3.则下列有关NH4HSO3溶液的叙述正确的是( )
| A. | 该溶液中,Na+、Cl-、S2-和SO42-可以大量共存 | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合,反应的离子方程式为:HSO3-+OH-=SO32-+H2O | |
| C. | NH4HSO3为弱酸弱碱盐,其水溶液pH>7 | |
| D. | c(NH4+)>c(HSO3-)>c(SO32-)>C(H2SO3)>C(NH3•H2O) |
4.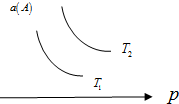 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
11.已知实验室制备氯气的反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,当生成7.1gCl2时,被氧化的HCl的质量是( )
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |