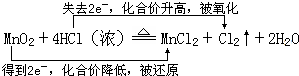
题目内容
8.为了从海带中提取碘,某研究性学习小组设计并进行了实验: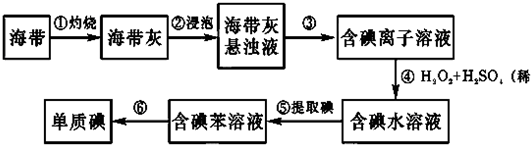
(1)步骤①灼烧海带时候,除需要酒精灯、三脚架和泥三角外,还要用到的仪器是C.
A.烧杯 B.试管 C.坩埚
(2)步骤③的实验操作名称是过滤.
(3)步骤④发生的是氧化还原反应,反应中H2O2作氧化剂.
(4)步骤⑤中,选用苯来提取碘的理由是苯与水互不相溶,碘在苯中的溶解度大于在水中的溶解度.
(5)写出步骤④的离子反应方程式:H2O2+2H++2I-=2H2O+I2.
分析 海带在坩埚中灼烧,海带灰浸泡后,过量除去杂质,含碘离子溶液加入过氧化氢,在酸性条件下发生氧化还原反应生成碘,⑤为萃取操作,用于分离碘,含碘苯溶液蒸馏可得到碘,以此解答该题.
解答 解:海带在坩埚中灼烧,海带灰浸泡后,过量除去杂质,含碘离子溶液加入过氧化氢,在酸性条件下发生氧化还原反应生成碘,⑤为萃取操作,用于分离碘,含碘苯溶液蒸馏可得到碘,
(1)步骤①灼烧海带,应在坩埚中灼烧,除需要酒精灯、三脚架和泥三角外,还要用到的仪器是坩埚,故答案为:C;
(2)步骤③用于分离固体和液体,为过滤操作,故答案为:过滤;
(3)过氧化氢具有强氧化性,在酸性条件下可氧化电离子生成碘,为氧化剂,故答案为:氧化剂;
(4)因苯与水互不相溶,碘在苯中的溶解度大于在水中的溶解度,可用苯作为萃取剂,故答案为:苯与水互不相溶,碘在苯中的溶解度大于在水中的溶解度;
(5)步骤④的离子反应方程式为H2O2+2H++2I-=2H2O+I2,故答案为:H2O2+2H++2I-=2H2O+I2.
点评 本题考查海水资源的综合利用,为高频考点,侧重于学生的分析、实验能力的考查,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,难度不大.

练习册系列答案
相关题目
10.在含有较多NH4+、Ba2+、Cl-的溶液中还能大量共存的离子是( )
| A. | SO42- | B. | OH- | C. | Ag+ | D. | Mg2+ |
11.已知氯仿通常是无色液体,不溶于水,密度约为水的1.5倍,沸点为61.2℃.要从水与氯仿的混合物中分离出氯仿,最合适的方法是( )
| A. | 蒸馏 | B. | 分液 | C. | 重结晶 | D. | 过滤 |
16.下列说法正确的是( )
| A. | 溶液和胶体的本质区别是丁达尔效应 | |
| B. | 液氨、氨水属于纯净物,盐酸和豆浆属于混合物 | |
| C. | 胶体区别于其它分散系的本质特征是粒子大小 | |
| D. | 能进行“交叉分类”的就不能进行“树状分类” |
17.下列实验操作正确的是( )
| A. | 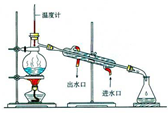 用如图装置分离甲苯和水 | |
| B. |  蒸干NH4Cl溶液制备NH4Cl晶体 | |
| C. | 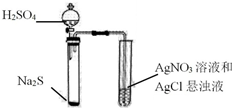 证明Ag2S溶解度小于AgCl | |
| D. | 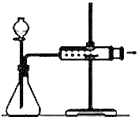 关闭分液漏斗活塞,向外拉动针筒活塞,松开后活塞恢复原位置,证明装置气密性良好 |
18.下列有关说法正确的是( )
| A. | KClO3和SO2溶于水后的溶液均可导电,故KClO3和SO2均为电解质 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下自发进行,则该反应的△H<0 | |
| D. | 向浓度均为0.1mol•L-1KI和NaCl混合溶液中,滴加几滴硝酸镍溶液,只得到AgI沉淀说明Ksp(Agl)<Ksp(AgCl) |