题目内容
1.下列离子方程式书写不正确的是( )| A. | Fe与HCl反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与AgNO3反应:2Ag++Cu═Cu2++2Ag | |
| C. | 醋酸与NaOH反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | CuSO4与Ba(OH)2反应:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓ |
分析 A.不符合反应客观事实;
B.二者反应生成硝酸铜和银;
C.二者发生酸碱中和生成醋酸钠和水;
D.二者反应生成硫酸钡沉淀和氢氧化铜沉淀.
解答 解:A.Fe与HCl反应,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.Cu与AgNO3反应,离子方程式:2Ag++Cu═Cu2++2Ag,故B正确;
C.醋酸与NaOH反应,离子方程式:CH3COOH+OH-═CH3COO-+H2O,故C正确;
D.CuSO4与Ba(OH)2反应,离子方程式:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故D正确;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
11. 化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )
化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )
 化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )
化学家们合成了一种新物质:五星烷,其键线式如图所示.下列关于五星烷的说法中正确的是( )| A. | 五星烷与己烷互为同系物 | B. | 五星烷的化学式为C15H20 | ||
| C. | 五星烷分子中含有7个五元环 | D. | 五星烷的一氯代物有5种 |
9.某兴趣小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧.他们对钠在CO2气体中燃烧后生成的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
(1)通过钠在CO2气体中燃烧的实验,你认为物质燃烧的条件是有可燃物;有助燃剂(氧化剂);可燃物必须达到着火点.
(2)实验室不小心发生钠着火,下列灭火方法正确的是D
A.用水扑灭 B.用泡沫灭火器扑灭 C.用干粉灭火器扑灭 D.用砂子扑灭
[提出假设]
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
[设计实验方案.验证假设]该小组对燃烧后生成的白色物质进行如下探究:
[思考与交流]
(3)甲同学认为方案1得到的结论不正确,其理由是碳酸钠溶液水解显碱性,使酚酞变红.
(4)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.理由是方案2的①中出现白色沉淀是BaCO3,所以燃烧后的白色物质中有Na2CO3,②中滴加无色酚酞试液无明显现象,说明燃烧后的白色固体中无Na2O.
(5)写出钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2O2+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素.
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
(1)通过钠在CO2气体中燃烧的实验,你认为物质燃烧的条件是有可燃物;有助燃剂(氧化剂);可燃物必须达到着火点.
(2)实验室不小心发生钠着火,下列灭火方法正确的是D
A.用水扑灭 B.用泡沫灭火器扑灭 C.用干粉灭火器扑灭 D.用砂子扑灭
[提出假设]
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
[设计实验方案.验证假设]该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(3)甲同学认为方案1得到的结论不正确,其理由是碳酸钠溶液水解显碱性,使酚酞变红.
(4)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.理由是方案2的①中出现白色沉淀是BaCO3,所以燃烧后的白色物质中有Na2CO3,②中滴加无色酚酞试液无明显现象,说明燃烧后的白色固体中无Na2O.
(5)写出钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2O2+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素.
16.某学生欲通过实验验证Fe2+的性质.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为探究溶液变为深棕色的原因,该同学进行了如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
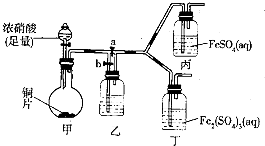
Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
| 实验操作 | 预期现象 | 离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.

Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
6.下列有关物质的性质或用途的叙述中,正确的是( )
| A. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 | |
| B. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硅是一种酸性氧化物,它不跟任何酸发生反应 |
13.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
10.在含有较多NH4+、Ba2+、Cl-的溶液中还能大量共存的离子是( )
| A. | SO42- | B. | OH- | C. | Ag+ | D. | Mg2+ |
11.已知氯仿通常是无色液体,不溶于水,密度约为水的1.5倍,沸点为61.2℃.要从水与氯仿的混合物中分离出氯仿,最合适的方法是( )
| A. | 蒸馏 | B. | 分液 | C. | 重结晶 | D. | 过滤 |