题目内容
9.某混合物X,含有Al2(SO4)3、Al2O3、Al粉和Mg粉,在一定条件下可实现如图所示的物质之间的变化: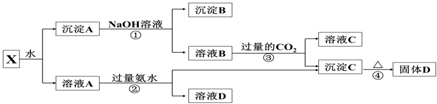
据此回答下列问题:
(1)写出沉淀B和固体D的化学式:BMgDAl2O3
(2)写出①、②、③过程反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(3)若②过程是加入过量的NaOH溶液,则反应的离子方程式为:Al3++4OH-=AlO2-+2H2O.
分析 Al2(SO4)3溶于水,Al2O3、Al粉和Mg粉均不溶于水,混合物X加水溶解后,溶液中A是Al2(SO4)3,沉淀是Al2O3、Al粉和Mg粉;
向沉淀中加NaOH溶液,Mgq不反应,沉淀B为Mg,Al、Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入过量的二氧化碳可得C为Al(OH)3沉淀,Al(OH)3受热分解生成固体D为Al2O3,溶液C含有NaHCO3;
向溶液A中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3•H2O,以此来解答.
解答 解:Al2(SO4)3溶于水,Al2O3、Al粉和Mg粉均不溶于水,混合物X加水溶解后,溶液中A是Al2(SO4)3,沉淀是Al2O3、Al粉和Mg粉;
向沉淀中加NaOH溶液,Mgq不反应,沉淀B为Mg,Al、Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入过量的二氧化碳可得C为Al(OH)3沉淀,Al(OH)3受热分解生成固体D为Al2O3,溶液C含有NaHCO3;
向溶液A中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3•H2O,
(1)由以上分析可知,B为Mg,D为Al2O3,故答案为:Mg;Al2O3;
(2)①涉及反应为Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,②涉及反应为Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4,
③涉及反应为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)若②过程是加入过量的NaOH溶液,发生的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
点评 本题考查物质的分离方法及选择,为高频考点,把握物质的性质及混合物分离提纯方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 蒸馏 | B. | 分液 | C. | 重结晶 | D. | 过滤 |
| A. | 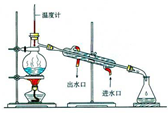 用如图装置分离甲苯和水 | |
| B. |  蒸干NH4Cl溶液制备NH4Cl晶体 | |
| C. | 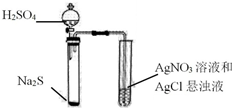 证明Ag2S溶解度小于AgCl | |
| D. | 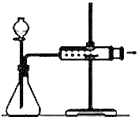 关闭分液漏斗活塞,向外拉动针筒活塞,松开后活塞恢复原位置,证明装置气密性良好 |
| 压强/106Pa | 1.01 | 2.02 | 40.4 |
| 平衡时c(A)/mol•L-1 | 0.022 | 0.05 | 0.075 |
①C一直为非气态;②C一直为气态;③第二次达到平衡时C为气态;④第三次达到平衡时C为非气态.
| A. | ② | B. | ③④ | C. | ②④ | D. | ①④ |
| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 | |
| B. | 25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH溶液与0.2 mol/L H2SO4恰好中和,所得溶液的pH<7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
| A. | KClO3和SO2溶于水后的溶液均可导电,故KClO3和SO2均为电解质 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下自发进行,则该反应的△H<0 | |
| D. | 向浓度均为0.1mol•L-1KI和NaCl混合溶液中,滴加几滴硝酸镍溶液,只得到AgI沉淀说明Ksp(Agl)<Ksp(AgCl) |
| A. | 四氯化碳分子的比例模型: | B. | 如图所示一定代表丙烯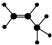 | ||
| C. | 12C32S2比12C34S2更易挥发 | D. | O${\;}_{2}^{2-}$电子式为: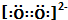 |
