题目内容
4.如图是实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出.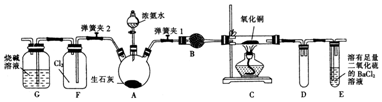
(1)在组装好装置之后,应进行的操作名称是检查装置的气密性.
(2)装置B中盛放的试剂是碱石灰(生石灰或固体NaOH).
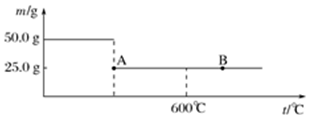
(3)当C中固体全部变为红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16g,反应后固体质量减少2.4g,则该固体产物的成分是Cu和Cu2O(用化学式表示).从E中逸出液面的气体可以直接排入空气中,请写出在C中发生反应的化学方程式:2NH3+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+2Cu+N2↑+3H2O.
(4)关闭弹簧夹1,打开弹簧夹2,气体进入F中立即产生白烟,同时发现G中溶液迅速倒吸流入F中.请写出产生白烟的化学方程式:3Cl2+8NH3═N2+6NH4Cl,迅速发生倒吸的原因是盛满氯气的集气瓶中因Cl2与NH3反应生成固体,导致F瓶内压强减小,引起溶液倒吸.
(5)为了证明一水合氨是弱碱,甲、乙两同学分别设计如下实验进行探究.
①甲同学用pH试纸测得室温下0.01mol•L-1氨水的pH为10,则认定一水合氨是弱电解质,理由是若NH3•H2O是强碱,0.01 mol•L-1氨水的pH应为12,而pH=10<12,故NH3•H2O没有完全电离,故为弱碱.
②乙同学取出10mL 0.1mol•L-1氨水,滴入2滴酚酞试液,溶液显粉红色,再加入少量NH4Cl晶体,观察到溶液颜色变浅,证明一水合氨是弱电解质.
③请设计一个与甲、乙同学不同的简单实验方案,证明一水合氨是弱电解质:测NH4Cl[或NH4NO3或(NH4)2SO4]溶液的pH,若pH<7,证明铵根离子可水解,故NH3•H2O为弱电解质.
分析 (1)该实验是实验室进行氨气快速制备与性质实验,因有气体参与,需检查装置的气密性;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(3)生成的红色物质可能为Cu2O、Cu或二者混合物,反应前固体质量为16g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,计算剩余固体中Cu、氧元素质量确定组成,进而计算n(Cu):n(O)确定组成;从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水;
(4)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl;盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸;
(5)①根据一定物质的量浓度的溶液的pH大小,确定电解质的电离程度,进而确定强弱电解质;
②如果氨水是弱碱,则存在电离平衡,加入含有相同离子的盐能改变平衡的移动,则溶液的颜色发生变化,如果不变化,则证明是强碱;
③利用测定溶液PH判断溶液呈酸性,证明铵根离子水解证明一水合氨是弱电解质,可根据铵盐溶液的酸碱性确定一水合氨电解质的强弱.
解答 解:(1)该实验是实验室进行氨气快速制备与性质实验,因有气体参与,需检查装置的气密性,方法为:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好,
故答案为:检查装置的气密性;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰,碱石灰的成分为生石灰或固体NaOH,
故答案为:碱石灰(生石灰或固体NaOH);
(3)16gCuO中含有Cu元素质量为16g×$\frac{64}{80}$=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:2NH3+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+2Cu+N2↑+3H2O,
故答案为:Cu和Cu2O;2NH3+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+2Cu+N2↑+3H2O;
(4)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,盛满氯气的集气瓶中因Cl2与NH3反应生成固体,导致F瓶内压强减小,引起溶液倒吸,
故答案为:3Cl2+8NH3=N2+6NH4Cl;盛满氯气的集气瓶中因Cl2与NH3反应生成固体,导致F瓶内压强减小,引起溶液倒吸;
(5)①如果氨水是强碱,0.010mol•L-1氨水C(H+)=$\frac{1{0}^{-14}}{0.01}$=10-12,PH=12,实际上溶液的pH=10<12,所以氨水是弱碱;
故答案为:若NH3•H2O是强碱,0.01 mol•L-1氨水的pH应为12,而pH=10<12,故NH3•H2O没有完全电离,故为弱碱;
②向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
故答案为:溶液颜色变浅;
③配制0.1mol/L的氯化铵溶液(或NH4NO3或(NH4)2SO4),将氯化铵溶液[或NH4NO3或(NH4)2SO4]滴到pH试纸上,测得其pH<7,说明氯化铵是强酸弱碱盐,则一水合氨是弱电解质,
故答案为:测NH4Cl[或NH4NO3或(NH4)2SO4]溶液的pH,若pH<7,证明铵根离子可水解,故NH3•H2O为弱电解质.
点评 本题考查氨气的性质实验,题目难度中等,根据氨水浓度与其pH的关系、稀释氨水时pH的变化及其强酸盐的PH确定一水合氨的强弱,知道电解质强弱与其电离程度有关,理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.


| 溶液 | 加入物质 | 对应的图象 |
| (1)饱和石灰水 | 通过量CO2气体 | |
| (2)氯化铝溶液 | 加入过量氨水 | |
| (3)MgCl2、AICl3的混合液 | 逐滴加入NaOH溶液至过量 | |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
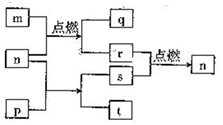 短周期主感元素X、Y、Z、W原子序数依次增大,W2+的电子层结构与氖相同,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种碱性氧化物,它们的关系如图所示( )
短周期主感元素X、Y、Z、W原子序数依次增大,W2+的电子层结构与氖相同,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种碱性氧化物,它们的关系如图所示( )| A. | Y、Z、W的简单离子半径:W>Z>Y | B. | 最高价氧化物的水化物的碱性:Z>W | ||
| C. | 简单气态氢化物的热稳定性:X>Y | D. | Y与Z形成的化合物中不含有共价键 |
| A. | 硫酸铝溶液加热蒸干再灼烧后,固体为Al2O3 | |
| B. | 将水加热,KW增大,pH不变,仍呈中性 | |
| C. | 温度不变,向水中加入少量碳酸钠固体,KW增大 | |
| D. | 向0.01 mol•L-1醋酸溶液中加水,溶液PH增大 |
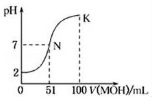 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
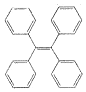 TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )
TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )| A. | TPE属于苯的同系物 | |
| B. | TPE能发生加成反应,但不能取代反应 | |
| C. | TPE与化合物 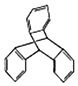 互为同分异构体 互为同分异构体 | |
| D. | TPE的一氯代物有3种 |
| A. | 0.5 mol/L | B. | 1.0 mol/L | C. | 1.5 mol/L | D. | 2.0 mol/L |