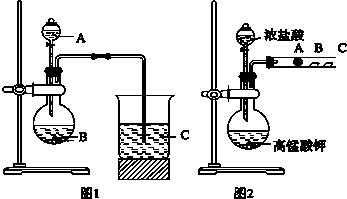
题目内容
12.下列现象与化学键有关的是( )| A. | H2O在高温下也难分解 | |
| B. | F2、Cl2、Br2、I2单质的熔点依次升高 | |
| C. | SiH4的熔点高于CH4的熔点 | |
| D. | NH3的沸点高于PH3的沸点 |
分析 发生化学反应时物质中的化学键被破坏,熔化及电离过程中化学键也被破坏,以此来分析.
解答 解:A、H2O在高温下难分解,是因为水很稳定,与氧氢键的键能有关,故A正确;
B、F2、Cl2、Br2、I2单质的熔点依次升高,是因为分子间作用力逐渐增强,与化学键无关,故B错误;
C、SiH4的熔点高于CH4的熔点,是因为两者均属于分子晶体,与分子间作用力有关,与化学键无关,故C错误;
D、NH3的沸点高于PH3的沸点,是因为氨气中存在分子间氢键,使沸点反常的升高故D错误.
故选A.
点评 本题考查化学键,熟悉化学反应中化学键变化是解答本题的关键,并注意利用分子间作用力、氢键不属于化学键来解答.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
2.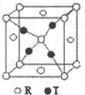 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
(1)T原子的价层电子排布图是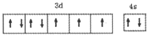 .
.
(2)在Y2X4分子中,Y原子的杂化轨道类型是sp2.
(3)用“<”或“>”填空:
(4)R和T形成的一种离子晶体结构如图,则该晶体中T离子的配位数是4.
(5)TR放入足量的XYZ溶液(呈弱酸性,分解温度1200℃)中,微热产生一种气体单质和[T(YZ)6]3-离子,该反应的离子方程式为2CoO+12HCN=2[Co(CN)6]3-+6H++H2↑+2H2O.
 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:(1)T原子的价层电子排布图是
 .
.(2)在Y2X4分子中,Y原子的杂化轨道类型是sp2.
(3)用“<”或“>”填空:
| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
(5)TR放入足量的XYZ溶液(呈弱酸性,分解温度1200℃)中,微热产生一种气体单质和[T(YZ)6]3-离子,该反应的离子方程式为2CoO+12HCN=2[Co(CN)6]3-+6H++H2↑+2H2O.
3.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )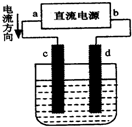

| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
20.下列物质中,含有共价键的离子晶体是( )
| A. | MgCl2 | B. | SO2 | C. | I2 | D. | NaOH |
7.下列各组指定的元素,不能形成AB2型共价化合物的是( )
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p2 | C. | 3s2和3s23p5 | D. | 2s22p3和2s22p4 |
1.下列表述正确的是( )
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| B. | 中和等体积、等pH的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 | |
| C. | 物质的量浓度相同的下列溶液:Na2CO3、KNO3、NH4Cl pH依次减小 | |
| D. | 将NH4Cl溶液蒸干制备NH4Cl固体 |
2.下列关于Na2CO3和NaHCO3的说法中,正确的是( )
| A. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| B. | 相同浓度时pH大小关系为:Na2CO3<NaHCO3 | |
| C. | 等质量的两种固体,分别与过量盐酸反应,生成CO2的质量碳酸氢钠多 | |
| D. | 分别取1mol/L的两种溶液,滴入氯化钙溶液,两个皆有沉淀产生 |