题目内容
7.下列各组指定的元素,不能形成AB2型共价化合物的是( )| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p2 | C. | 3s2和3s23p5 | D. | 2s22p3和2s22p4 |
分析 AB2型化合物中A的化合价为+2或者+4价,B的化合价为-1或-2价,根据价电子排布判断化合价是否符合.
解答 解:A.价层电子排布为2S22P2的元素为C,价层电子排布为2S22P4的元素为O,二者可形成CO2,故A不选;
B.价层电子排布为3S23P4的元素为S,价层电子排布为2S22P2的元素为C,二者可形成CS2,故B不选;
C.价层电子排布为3S2的元素为Mg,价层电子排布为2S22P5的元素为F,二者可形成MgF2,与题目不符,故C选;
D.价层电子排布为2s22p3的元素为N,价层电子排布为2S22P4的元素为O,二者可形成NO2,故D不选;
故选C.
点评 本题考查原子核外电子排布,题目难度不大,本题注意把握核外电子的排布特点,把握常见元素的化合价.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列有关饱和Na2CO3溶液的叙述正确的是( )
| A. | 该溶液中H+、NH4+、NO3-、Al3+可以大量共存 | |
| B. | 该溶液中通入足量CO2气体无明显现象 | |
| C. | 用该溶液浸泡锅炉中的水垢,可使硫酸钙转化为碳酸钙 | |
| D. | 与苯酚溶液反应的离子方程式为:2C6H5OH+CO32-→2C6H5O-+H2O+CO2↑ |
18.两只敞口烧杯中分别发生如下反应:一只烧杯中反应为:A+B=C+D,反应温度为T1,另一只烧杯中反应为:M+N=P+Q,反应温度为T2,T1>T2,则两只烧杯中反应速率快慢为( )
| A. | 无法确定 | B. | 前者快 | C. | 后者快 | D. | 一样快 |
2.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p4; ③1s22s22p5
则下列有关比较中不正确的是( )
则下列有关比较中不正确的是( )
| A. | 最高正化合价:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 第一电离能:③>②>① |
12.下列现象与化学键有关的是( )
| A. | H2O在高温下也难分解 | |
| B. | F2、Cl2、Br2、I2单质的熔点依次升高 | |
| C. | SiH4的熔点高于CH4的熔点 | |
| D. | NH3的沸点高于PH3的沸点 |
19.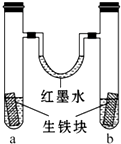 如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
 如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )| A. | 生铁块中的碳是原电池的正极 | |
| B. | 红墨水柱两边的液面变为左低右高 | |
| C. | 两试管中相同的电极反应式是:Fe-2e-═Fe2+ | |
| D. | a试管中O2得电子,b试管中H+ 得电子 |
16.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1,则含20.0g溶质的NaOH稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
17.分类是学习和研究化学的一种重要方法,下列对于Na2O的分类合理的是( )
| A. | 属于盐 | B. | 属于碱 | C. | 属于酸 | D. | 属于氧化物 |
 B位于周期表中第二周期ⅦA族.
B位于周期表中第二周期ⅦA族.