题目内容
3.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )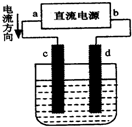
| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
分析 A、依据装置图中电流流向分析电极名称,与电源正极连接的为阳极;
B、依据电解池中电解原理分析判断,c电极为阳极,溶液中的氯离子放电生成氯气;
C、电解池中溶液中阴离子移向阳极;
D、溶液中铜离子在阴极得到电子析出铜,氯离子在阳极失电子生成氯气.
解答 解:A、装置图中电流流向判断a为电源正极,与a连接的电极c为阳极;b为电源负极,与负极相连的电极d为阴极;故A错误;
B、电解过程中c电极是阳极,溶液中氯离子失电子发生氧化反应生成氯气,故B错误;
C、电解过程中,氯离子在溶液中移向阳极c,故C错误;
D、溶液中铜离子在阴极得到电子析出铜,电解过程中,d电极质量增加,故D正确;
故选D.
点评 本题考查电解原理的分析应用,电极名称、电极反应和电极产物的分析判断是解题关键,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
16.乙烷的二氯代物和四氯代物的种类相同,都为( )
| A. | 3种 | B. | 2种 | C. | 4种 | D. | 无法判断 |
14.下列制备物质的工业生产流程合理是( )
| A. | 由铝土矿冶铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| B. | 制硫酸:硫铁矿$→_{空气}^{高温}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| C. | 由NaCl制漂白粉:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| D. | 合成氨:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
11.不能使酸性KMnO4溶液褪色的是( )
| A. | 甲苯 | B. | 聚乙烯 | C. | SO2 | D. | 乙炔 |
18.两只敞口烧杯中分别发生如下反应:一只烧杯中反应为:A+B=C+D,反应温度为T1,另一只烧杯中反应为:M+N=P+Q,反应温度为T2,T1>T2,则两只烧杯中反应速率快慢为( )
| A. | 无法确定 | B. | 前者快 | C. | 后者快 | D. | 一样快 |
8.下列有关金属镁说法不正确的是( )
| A. | Mg在CO2中燃烧生成MgO和C,是放热反应 | |
| B. | 工业上通过电解MgCl2溶液制取金属镁 | |
| C. | Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率 | |
| D. | 镁可以用来制造信号弹和焰火,MgO可以作耐高温材料 |
12.下列现象与化学键有关的是( )
| A. | H2O在高温下也难分解 | |
| B. | F2、Cl2、Br2、I2单质的熔点依次升高 | |
| C. | SiH4的熔点高于CH4的熔点 | |
| D. | NH3的沸点高于PH3的沸点 |
13.对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1最准确的理解是( )
| A. | 1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量 | |
| B. | 1 mol碳和1 mol水反应生成1 molCO和 1 mol H2,同时放出131.3 kJ热量 | |
| C. | 固体碳和水蒸汽反应吸收131.3 kJ热量 | |
| D. | 1个碳原子和1个水分子反应,吸热131.1 kJ |
 B位于周期表中第二周期ⅦA族.
B位于周期表中第二周期ⅦA族.