题目内容
1.下列表述正确的是( )| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| B. | 中和等体积、等pH的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 | |
| C. | 物质的量浓度相同的下列溶液:Na2CO3、KNO3、NH4Cl pH依次减小 | |
| D. | 将NH4Cl溶液蒸干制备NH4Cl固体 |
分析 A.pH=7时,c(H+)=c(OH-),结合电荷守恒判断;
B.醋酸为弱酸,pH相同时醋酸的浓度大于盐酸;
C.碳酸钠溶液、硝酸钾溶液、氯化铵溶液分别呈碱性、中性、酸性;
D.氯化铵加热易分解,蒸干氯化铵溶液无法得到氯化铵固体.
解答 解:A.常温下溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),正确的离子浓度大小为:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故A错误;
B.中和等体积、等pH的盐酸和CH3COOH溶液,由于醋酸的浓度大于盐酸,则所消耗的NaOH物质的量:醋酸>盐酸,故B错误;
C.Na2CO3、KNO3、NH4Cl溶液分别显示碱性、中性和酸性,则三种溶液的pH依次减小,故C正确;
D.氯化铵加热易分解,将NH4Cl溶液蒸干无法获得NH4Cl固体,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、溶液酸碱性与溶液pH大小比较、弱电解质的电离等知识,明确电荷守恒、盐的水解原理的应用方法为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
11.不能使酸性KMnO4溶液褪色的是( )
| A. | 甲苯 | B. | 聚乙烯 | C. | SO2 | D. | 乙炔 |
12.下列现象与化学键有关的是( )
| A. | H2O在高温下也难分解 | |
| B. | F2、Cl2、Br2、I2单质的熔点依次升高 | |
| C. | SiH4的熔点高于CH4的熔点 | |
| D. | NH3的沸点高于PH3的沸点 |
9.元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)上表中与A属于同一周期的元素是(写元素符号)Mg,画出D离子的结构示意图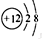 .
.
(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式2F2+2H2O=4HF+O2
(3)对元素B的单质或化合物描述正确的是bd.
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称)钠.
| 元素 | 性质或结构信息 |
| A | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
| B | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍 |
| C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
| D | +2价阳离子的核外电子排布与氖原子相同 |
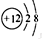 .
.(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式2F2+2H2O=4HF+O2
(3)对元素B的单质或化合物描述正确的是bd.
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称)钠.
16.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1,则含20.0g溶质的NaOH稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
6.下列变化中,由取代反应引起的是( )
| A. | 乙烯通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 | |
| B. | 在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 | |
| C. | 在一定条件下,苯与氢气反应生成环己烷 | |
| D. | 在催化剂作用下,乙烯与水反应生成乙醇 |
13.对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1最准确的理解是( )
| A. | 1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量 | |
| B. | 1 mol碳和1 mol水反应生成1 molCO和 1 mol H2,同时放出131.3 kJ热量 | |
| C. | 固体碳和水蒸汽反应吸收131.3 kJ热量 | |
| D. | 1个碳原子和1个水分子反应,吸热131.1 kJ |
10.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和Si | B. | CO2和H2O | C. | NaCl和HCl | D. | CCl4和KCl |
11.下列反应不属于氧化还原反应的是( )
| A. | 2NaOH+Cl2=NaCl+NaClO+H2O | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO |