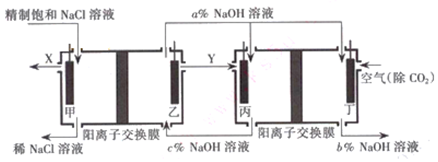
题目内容
13.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-Q1KJ•mol-1H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-$\frac{1}{2}$Q2•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-$\frac{1}{2}$Q3•mol-1
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:KJ)为( )
| A. | 0.4Q1+0.05Q3 | B. | 0.4Q1+0.05Q2 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,根据体积比较计算甲烷、氢气的物质的量,再根据热化学方程式计算燃烧放出的热量.
解答 解:标准状况下11.2L甲烷和氢气混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,甲烷和氢气的体积之比为4:1,所以甲烷的物质的量为:0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol,
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-Q1 kJ•mol-1 可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1 kJ•mol-1=0.4Q1 kJ,
由H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-$\frac{1}{2}$Q3kJ•mol-1可知,
0.1mol氢气燃烧放出的热量为$\frac{0.1mol}{2}$×$\frac{1}{2}$Q3kJ•mol-1=0.05Q3kJ,
所以放出的热量为0.4Q1kJ+0.05Q3kJ=(0.4Q1+0.05Q3)kJ,
故选A.
点评 本题考查根据热化学方程式进行的有关反应热的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
4.下列反应属于加成反应的是( )
| A. | 乙烯使溴水褪色 | |
| B. | 甲烷与氯气在光照条件下的反应 | |
| C. | 苯和液溴在铁作催化剂的条件下反应 | |
| D. | 乙醇与氧气在铜作催化剂及加热条件下的反应 |
1.下列分子中,所有原子的最外层均为8电子稳定结构的是( )
| A. | BeCl2 | B. | H2S | C. | PCl3 | D. | SF4 |
8.现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现做如下实验,请回答:
(1)甲瓶溶液为AlCl3溶液.
(2)乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
(2)乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
18.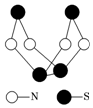 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | |
| B. | 该物质的分子中只含共价键 | |
| C. | 该物质具有很高的熔、沸点 | |
| D. | 该物质与化合物S2N2互为同素异形体 |