题目内容
4.下列反应属于加成反应的是( )| A. | 乙烯使溴水褪色 | |
| B. | 甲烷与氯气在光照条件下的反应 | |
| C. | 苯和液溴在铁作催化剂的条件下反应 | |
| D. | 乙醇与氧气在铜作催化剂及加热条件下的反应 |
分析 A.乙烯含碳碳双键;
B.甲烷中H被Cl取代;
C.苯中H被Br取代;
D.乙醇中-OH转化为-CHO.
解答 解:A.乙烯使溴水褪色,碳碳双键转化为单键,为加成反应,故A选;
B.甲烷中H被Cl取代,生成卤代烃,为取代反应,故B不选;
C.苯中H被Br取代,生成溴苯,为取代反应,故C不选;
D.乙醇中-OH转化为-CHO,生成乙醛,为氧化反应,故D不选;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
4.下列两种粒子的半径大小排列正确的是( )
| A. | Na>O | B. | Na+>O2- | C. | Mg>Na | D. | Mg2+>Na+ |
12.下列说法中正确的是( )
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 用硫酸清洗锅垢中的水垢 | |
| C. | 用SO2漂白纸浆和草帽辫 | |
| D. | 因为浓硫酸有强氧化性,故浓硫酸可用于干燥H2和CO |
9.在使酚酞变红的溶液中,能大量共存的离子组是( )
| A. | Na+ HCO3- SO42- Br- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+ Cl- NO3- | D. | Fe3+ K+ SO42- Cl- |
16.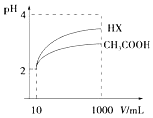 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填字母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-)
D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=11:9.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5mol•L-1 | K1=4.4×10-7mol•L-1 K2=5.6×10-11mol•L-1 | 3.0×10-8 mol•L-1 |
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填字母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-)
D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=11:9.
13.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-Q1KJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-$\frac{1}{2}$Q2•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-$\frac{1}{2}$Q3•mol-1
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:KJ)为( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-$\frac{1}{2}$Q2•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-$\frac{1}{2}$Q3•mol-1
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:KJ)为( )
| A. | 0.4Q1+0.05Q3 | B. | 0.4Q1+0.05Q2 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
14.下列过程不涉及化学变化的是( )
| A. | 石油分馏 | B. | 煤干馏 | C. | 氯碱工业 | D. | 海水提碘 |