题目内容
5.从A.甲烷 B.甲醛 C.乙酸 D.油脂 E.纤维素 F.聚乙烯六种有机物中选择合适的物质,将其标号添在横线上.(1)瓦斯的主要成分是A;
(2)可制成食品保鲜膜和保鲜袋的F;
(3)食醋可做增强食品酸味的调味剂,是因为其中含有C;
(4)福尔马林溶液可以作为保存动物标本的溶液,是因为其中含有35%的B;
(5)可用来制造肥皂的原料的是D;
(6)纯棉的衣服的化学成分是E.
分析 (1)瓦斯的主要成分是甲烷;
(2)聚乙烯可制成食品保鲜膜或保鲜袋;
(3)食醋中含乙酸,可作为增加食品酸味的调味剂;
(4)福尔马林是35%的甲醛溶液;
(5)油脂可作为制造肥皂原料;
(6)纯棉的衣服由棉花制成,而棉花的主要成分为纤维素.
解答 解:(1)瓦斯的主要成分是甲烷,则选择A,故答案为:A;
(2)聚乙烯可制成食品保鲜膜或保鲜袋,则选择F,故答案为:F;
(3)食醋中含乙酸,可作为增加食品酸味的调味剂,则选择C,故答案为:C;
(4)福尔马林是35%的甲醛溶液,故答案为:B;
(5)油脂可作为制造肥皂原料,则选择D,故答案为:D;
(6)纯棉的衣服由棉花制成,而棉花的主要成分为纤维素,则选择E,故答案为:E.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握常见有机物的组成、结构和性质,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
16. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填字母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-)
D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
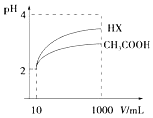
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=11:9.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5mol•L-1 | K1=4.4×10-7mol•L-1 K2=5.6×10-11mol•L-1 | 3.0×10-8 mol•L-1 |
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填字母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-)
D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=11:9.
13.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-Q1KJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-$\frac{1}{2}$Q2•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-$\frac{1}{2}$Q3•mol-1
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:KJ)为( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-$\frac{1}{2}$Q2•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-$\frac{1}{2}$Q3•mol-1
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:KJ)为( )
| A. | 0.4Q1+0.05Q3 | B. | 0.4Q1+0.05Q2 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
10.下列化合物的核磁共振氢谱中出现三个峰的是( )
| A. | 2,5-二甲基己烷 | B. | 2,2-二甲基丙烷 | ||
| C. | 2,6-二甲基庚烷 | D. | 2,2,3,3-四甲基丁烷 |
14.下列过程不涉及化学变化的是( )
| A. | 石油分馏 | B. | 煤干馏 | C. | 氯碱工业 | D. | 海水提碘 |
 图为元素X的前五级电离能的数值示意图.已知X的原子序数小于20,请写出X基态原子核外电子的轨道表示式
图为元素X的前五级电离能的数值示意图.已知X的原子序数小于20,请写出X基态原子核外电子的轨道表示式 .
.