题目内容
8.现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现做如下实验,请回答:| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
(2)乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
分析 氯化铝滴入NaOH溶液中,开始氢氧化钠过量,开始发生反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;
氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,
由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液;
由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,计算NaOH溶液的物质的量,进而计算NaOH的浓度.
解答 解:氯化铝滴入NaOH溶液中,开始氢氧化钠过量,开始发生反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;
氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,
由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,
由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,
1.56g沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,
则NaOH的物质的量为0.02mol×3=0.06mol,
故NaOH溶液的物质的量浓度为$\frac{0.06mol}{0.12L}$=0.5mol/L,
故答案为:(1)AlCl3;(2)NaOH;0.5.
点评 本题考查离子反应方程式有关计算,为高频考点,注意正确判断甲、乙成分是解题关键,侧重考查学生对数据的分析处理能力及计算能力,题目难度较大.

| A. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应H++OH-═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙跟盐酸反应CaCO3+2HCl═2Ca++H2CO3↑ |
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5mol•L-1 | K1=4.4×10-7mol•L-1 K2=5.6×10-11mol•L-1 | 3.0×10-8 mol•L-1 |
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填字母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-)
D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
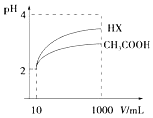
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=11:9.
| A. | 粗盐先通过除杂、精制得到饱和食盐水,然后电解得到氯气,最后和石灰乳反应制得漂白粉 | |
| B. | 苦卤酸化后通入氯气得到溴水,然后用热空气将其通入到SO2水溶液中,最后通入氯气后蒸馏得粗溴 | |
| C. | 干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质 | |
| D. | 向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,最后电解该溶液得到镁单质 |
 图为元素X的前五级电离能的数值示意图.已知X的原子序数小于20,请写出X基态原子核外电子的轨道表示式
图为元素X的前五级电离能的数值示意图.已知X的原子序数小于20,请写出X基态原子核外电子的轨道表示式 .
.