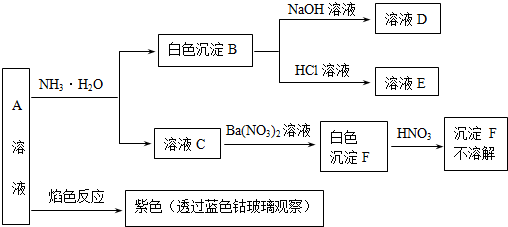
题目内容
15.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
分析 A.溶液体积不知不能计算微粒数;
B.n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算,1个乙酸分子中含3个C-H键;
C.铜和硫单质反应生成硫化亚铜;
D.白磷分子中含有6个P-P共价键,白磷分子式为P4,据此进行计算含有共价键数目;
解答 解:A.在0.1mol/L Na2CO3溶液中,溶液体积不知不能计算CO32-的数目,故A错误;
B.6.0 g乙酸物质的量n=$\frac{6.0g}{60g/mol}$=0.1mol,1个乙酸分子中含3个C-H键,含有0.3 NA个C-H键,故B正确;
C.32gCu物质的量=$\frac{32g}{64g/mol}$=0.5mol,与足量硫黄充分反应,2Cu+S=Cu2S,转移0.5NA个电子,故C错误;
D.白磷是正四面体型结构,分子中含有6个P-P共价键;31 g白磷(分子式为P4)的物质的量是0.25mol,所以分子中含有P-P共价键1.5mol,含有的共价键数目为1.5 NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确物质微粒结构是解题关键.

练习册系列答案
相关题目
17.25℃时,下列各组离子在指定溶液中一定能够大量共存的是( )
| A. | 0.1mol•L-1的A1Cl3溶液中:Na+、K+、CO32-、NO3- | |
| B. | pH=13的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(OH-)=1×10-13mol•L-1的溶液中:Mg2+、K+、Cl-、SO42- | |
| D. | 无色透明溶液中:Ca2-、NH4+、MnO4-、SO42- |
3.下列说法中正确的是( )
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
10.下列离子方程式正确的为( )
| A. | 少量NaHCO3与过量Ca(OH)2反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 在CuSO4溶液中加Ba(OH)2溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2S溶液中通入H2S气体 S2-+H+═HS- | |
| D. | NaHCO3溶液与KHSO4溶液反应 HCO3-+H+═CO2↑+H2O |
7.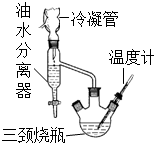 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
②乳酸乙酯易溶于苯、乙醇;
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
4.要除去石英沙中的少量杂质碳酸钙,可采用的方法是( )
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
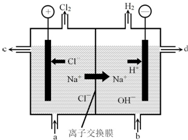 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.