题目内容
7.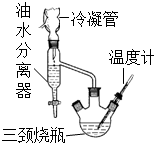 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
分析 (1)酯化反应过程中需要浓硫酸作催化剂和吸水剂;形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;油水分离器中液体不再变化说明反应结束;
(2)水洗的目的主要是除去催化作用的硫酸,因此洗涤液显酸性;
(3)乳酸乙酯分子的结构简式为CH3CH(OH)COOCH2CH3,分子中有5种不同环境的氢原子.
解答 解:(1)酯化反应利用浓硫酸作催化剂和吸水剂,故缺少浓硫酸,酯化反应是可逆反应,混合物中添加苯可形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行,如果收集装置中液体的量不再增加说明反应已经完全,
故答案为:浓硫酸;形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;油水分离器中液体不再增加;
(2)最后一次洗涤液不显酸性,可说明洗涤完全,因此只要测定一下最后一次水洗液的pH到7即可判断,故答案为:测定水洗液的pH至7;
(3)乳酸乙酯分子的结构简式为CH3CH(OH)COOCH2CH3,分子中有5种不同环境的氢原子,乳酸乙酯分子核磁共振氢谱中有5个峰,
故答案为:5.
点评 本题考查有机物制备实验,涉及酯化反应、物质的分离提纯、平衡移动原理应用、对信息的获取与运用、实验基本操作、核磁共振氢谱等,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列关于实验原理或操作的叙述不正确的是( )
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 利用重结晶可对粗苯甲酸进行提纯 | |
| C. | 不能用核磁共振氢谱来鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
15.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
2. Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
(1)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另外一种耐高温物质X,写出该反应的化学方程式4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$3TiC+2Al2O3.
(2)Fe原子的价电子排布式为3d64s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.Fe和Mn的部分电离能数据如右表:
其中表示Fe电离能数据的是B (填A或B).
(3)向CuSO4溶液中加入氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液;最后向溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O(注:[Cu(NH3)4]2+为平面正四边形结构),该晶体存在的粒子中空间构型为正四面体的是SO42-,与其互为等电子体的分子为SiF4、CCl4(GeCl4)(写出两个即可);N原子的杂化方式为sp3.
(4)Cu2O的晶胞结构如图所示,Cu+的配位数为2,该晶胞的边长为a pm,则Cu2O的密度为$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$g/cm3(阿佛加德罗常数用NA表示,1m=1012pm)
 Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:(1)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另外一种耐高温物质X,写出该反应的化学方程式4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$3TiC+2Al2O3.
(2)Fe原子的价电子排布式为3d64s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.Fe和Mn的部分电离能数据如右表:
| 元素 | A | B | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)向CuSO4溶液中加入氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液;最后向溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O(注:[Cu(NH3)4]2+为平面正四边形结构),该晶体存在的粒子中空间构型为正四面体的是SO42-,与其互为等电子体的分子为SiF4、CCl4(GeCl4)(写出两个即可);N原子的杂化方式为sp3.
(4)Cu2O的晶胞结构如图所示,Cu+的配位数为2,该晶胞的边长为a pm,则Cu2O的密度为$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$g/cm3(阿佛加德罗常数用NA表示,1m=1012pm)
12.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
19.在0.1mol•L-1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
16.800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
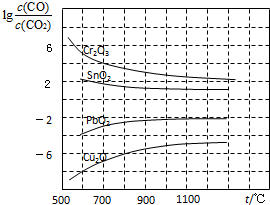 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.