题目内容
10.下列离子方程式正确的为( )| A. | 少量NaHCO3与过量Ca(OH)2反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 在CuSO4溶液中加Ba(OH)2溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2S溶液中通入H2S气体 S2-+H+═HS- | |
| D. | NaHCO3溶液与KHSO4溶液反应 HCO3-+H+═CO2↑+H2O |
分析 A.碳酸氢钠少量,反应生成碳酸钙、氢氧化钠和水;
B.漏掉铜离子与氢氧根离子的反应;
C.硫化氢为弱酸应保留化学式;
D.二者反应生成二氧化碳和水、硫酸钠、硫酸钾.
解答 解:A.少量NaHCO3与过量Ca(OH)2反应,离子方程式:Ca2++OH-+HCO3-═CaCO3↓+H2O,故A错误;
B.在CuSO4溶液中加Ba(OH)2溶液,离子方程式:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故B错误;
C.Na2S溶液中通入H2S气体,离子方程式 S2-+H2S═2HS-,故C错误;
D.NaHCO3溶液与KHSO4溶液反应,离子方程式:HCO3-+H+═CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分、注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
12.下列叙述正确的是( )
| A. | 等质量的乙烯与乙醇充分燃烧时消耗氧气的质量相等 | |
| B. | 生活中用于制造水杯、奶瓶、食物保鲜膜等用品的聚氯乙烯是通过加聚反应得到的 | |
| C. | 分子式为C6H12的某链状有机物,6个碳原子肯定在同一平面上,则与氢气加成后产物的名称为2,3-二甲基丁烷 | |
| D. | 红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构分别如图所示: 太阳能光触媒则红斑素和红曲素互为同分异构体 |
5.已知某密闭容器中发生反应:X(g)+Y(g)?2W(g)+Z(g)△H<0 (Y 物质易被液化).下列有关说法中一定正确的是( )
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
15.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
2. Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
(1)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另外一种耐高温物质X,写出该反应的化学方程式4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$3TiC+2Al2O3.
(2)Fe原子的价电子排布式为3d64s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.Fe和Mn的部分电离能数据如右表:
其中表示Fe电离能数据的是B (填A或B).
(3)向CuSO4溶液中加入氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液;最后向溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O(注:[Cu(NH3)4]2+为平面正四边形结构),该晶体存在的粒子中空间构型为正四面体的是SO42-,与其互为等电子体的分子为SiF4、CCl4(GeCl4)(写出两个即可);N原子的杂化方式为sp3.
(4)Cu2O的晶胞结构如图所示,Cu+的配位数为2,该晶胞的边长为a pm,则Cu2O的密度为$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$g/cm3(阿佛加德罗常数用NA表示,1m=1012pm)
 Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:(1)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另外一种耐高温物质X,写出该反应的化学方程式4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$3TiC+2Al2O3.
(2)Fe原子的价电子排布式为3d64s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.Fe和Mn的部分电离能数据如右表:
| 元素 | A | B | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)向CuSO4溶液中加入氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液;最后向溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O(注:[Cu(NH3)4]2+为平面正四边形结构),该晶体存在的粒子中空间构型为正四面体的是SO42-,与其互为等电子体的分子为SiF4、CCl4(GeCl4)(写出两个即可);N原子的杂化方式为sp3.
(4)Cu2O的晶胞结构如图所示,Cu+的配位数为2,该晶胞的边长为a pm,则Cu2O的密度为$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$g/cm3(阿佛加德罗常数用NA表示,1m=1012pm)
19.在0.1mol•L-1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
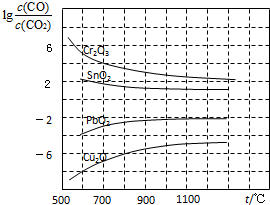 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.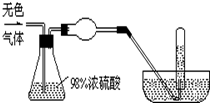 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断: