题目内容
16.高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能.某课外学习小组设计如下方案制备高铁酸钾: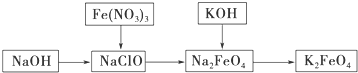
(1)高铁酸钾中铁元素的化合价为+6,推测它具有的化学性质是强氧化性.
(2)已知Fe2O3与KNO3和KOH的混合物加热共融也可制得高铁酸钾.完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH-□□+□KNO2+□□
(3)将KOH加入含Na2FeO4的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4═K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度大于(填“大于”、“小于”或“等于”)高铁酸钾的溶解度.
(4)为测定含铁溶液中铁元素的总含量,实验操作:
①准确量取20.00mL含铁溶液于带塞锥形瓶中,加入足量H2O2,待充分反应后,加热除去过量H2O2;
②加入过量KI充分反应后,再用0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00ml.已知:2Fe3++2I-═2Fe2++I2 I2+2S2032-═2I-+S4O62-
①写出滴定选用的指示剂淀粉,滴定终点观察到的现象溶液由蓝色变无色且保持半分钟不变色.
②溶液Ⅰ中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
分析 (1)依据高铁酸钾中氧元素化合价为-2价,钾元素化合价为+1价,根据各元素化合价代数和为0计算得到铁元素的化合价;元素化合价处于最高价态时有影响,处于最低价态有还原性,中间价态既具有影响也具有还原性,据此推测;
(2)Fe2O3与KNO3的反应中,氮由+5价变为+3价,反应要制得高铁酸钾,则铁由+3价变为+6价,根据化合价升降了元素守恒可完成化学方程式;
(3)根据复分解反应的条件可知,反应是向更难溶的方向进行;
(4)①反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;
②根据反应2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-找出关系式Fe3+~S2O32-,然后根据关系式计算出铁离子的物质的量,再根据c=$\frac{n}{V}$计算出铁元素含量;根据双氧水对消耗S2O32-的物质的量的影响判断误差.
解答 解:(1)在K2FeO4中,K元素的化合价为+1价,O元素的化合价为-2价,
设该化合物中Fe元素的化合价为x,
由化学式和化合物中正负化合价的代数和为零,则
(+1)×2+x+(-2)×4=0
解得x=+6
铁元素处于最高价态应有强氧化性,
故答案为:+6,强氧化性;
(2)Fe2O3与KNO3的反应中,氮由+5价变为+3价,反应要制得高铁酸钾,则铁由+3价变为+6价,根据化合价升降了元素守恒可知反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
故答案为:1、3、4、2K2FeO4、3、2H2O;
(3)根据复分解反应原理,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH,能进行说明生成了更难溶的物质,所以高铁酸钠的溶解度大于高铁酸钾的溶解度,
故答案为:大于;
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,
故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
②由2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-可得:Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为$\frac{56g/mol×0.002mol}{0.02L}$=5.6g/L;H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高.
点评 本题考查了物质的制备流程的理解应用、实验基本操作、氧化还原反应配平、物质性质的分析应用、有关方程式的计算等,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,熟练掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 生铁、普通钢和不锈钢中的碳含量依次增加 | |
| C. | 装修门窗使用的铝合金材料的硬度比铝大,熔点比铝低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| A. | 铜溶于稀硝酸:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 三氯化铁溶液腐蚀印刷电路板:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 小苏打溶液中加足量澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ |

| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物的不饱和度为10 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应、消去反应 |
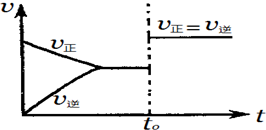
| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |

| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3•H2O) |


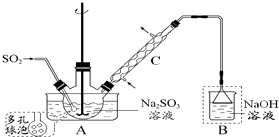 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得: