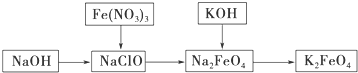
题目内容
7.下列有关金属及合金的说法不正确的是( )| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 生铁、普通钢和不锈钢中的碳含量依次增加 | |
| C. | 装修门窗使用的铝合金材料的硬度比铝大,熔点比铝低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
分析 A.金属的最主要用途是用来制造合金,要了解常见合金的组成和用途;
B.根据含碳量的多少把铁合金分为生铁和钢;
C.铝合金材料性能比金属单质高;
D.利用氧化铝的结构来分析对金属的保护作用.
解答 解:A.目前我国流通的硬币是由合金材料制成:1角的为不锈钢,5角的为钢芯镀铜,1元的为钢芯镀镍,故A正确;
B.生铁含碳量最高,普通钢次之,不锈钢最少.题目说法与事实相反,故B错误;
C.铝合金材料性能比金属单质高,则装修门窗使用的铝合金材料的硬度比铝大,熔点比铝低,故C正确;
D.铝表面覆盖致密的氧化物薄膜,对金属起保护作用,故D正确.
故选B.
点评 本题考查了金属镁铝的性质及用途,合金的组成及应用,难度不大,要求同学们要关心生活中的化学问题,学以致用.

练习册系列答案
相关题目
7.X、Y、Z为短周期主族元素,X的最外层电子数为内层电子数的2倍,Y的最高化合价与最低化合价的代数和为4,Z与Y同周期,Z的原子半径小于Y.下列叙述不正确的是( )
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |
4.已知:乙二酸(H2C2O4)是一种二元弱酸.向10mL0.1mol•-1Na2C2O4溶液中逐滴加入amL0.1mol•L-1盐酸(混合前后溶液体积变化可忽略).下列说法正确的是( )
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(H2C2O4)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)=0.04mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
12.下列各项中“操作或现象”能达到预期“实验目的”的是( )
| 选项 | 实验目的 | 操作或现象 |
| A | 检验甲酸溶液中是否含有甲醛 | 向溶液中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,有红色沉淀产生 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖是否已水解 | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热 |
| D | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向上层清液中加稀HNO3酸化,再滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
17.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图示.已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
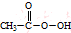 (过氧乙酸)+H2O
(过氧乙酸)+H2O